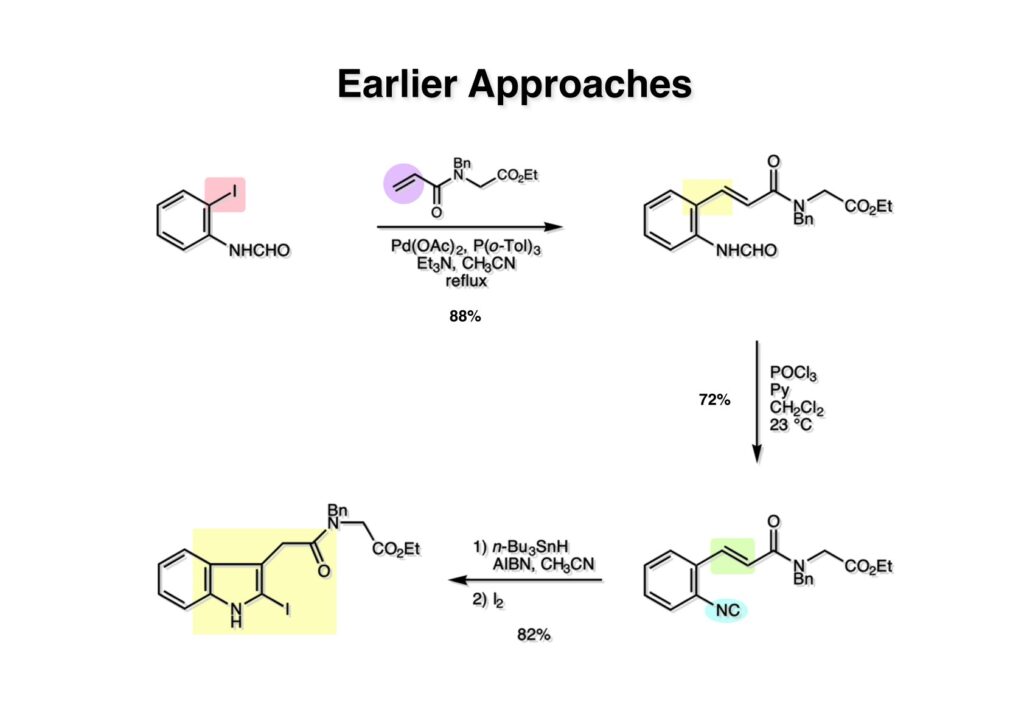
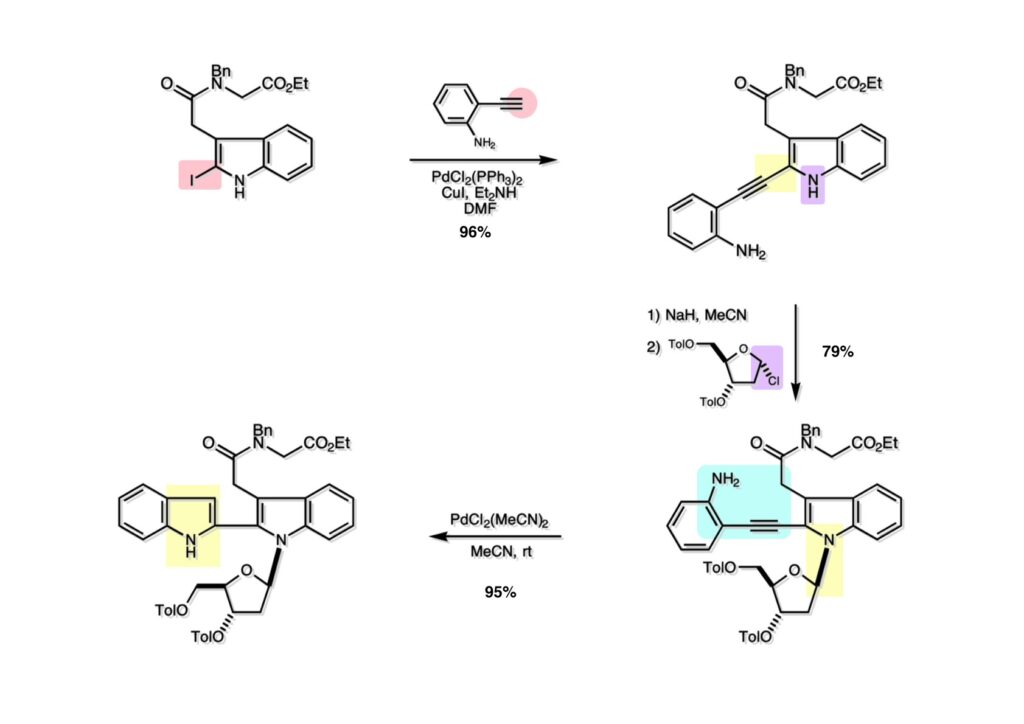
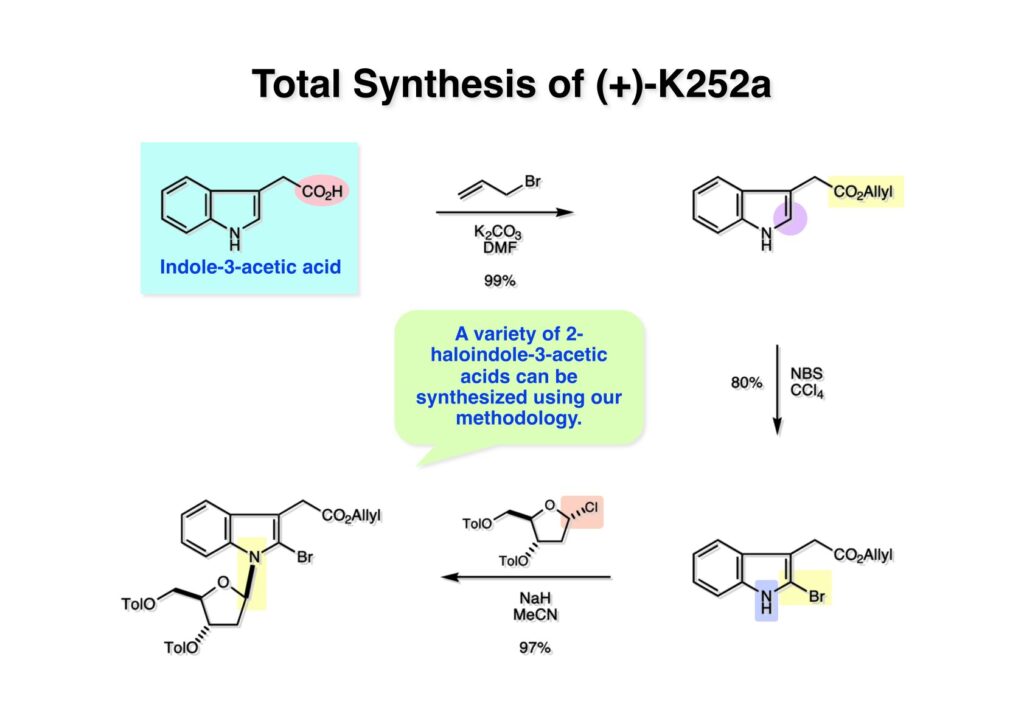
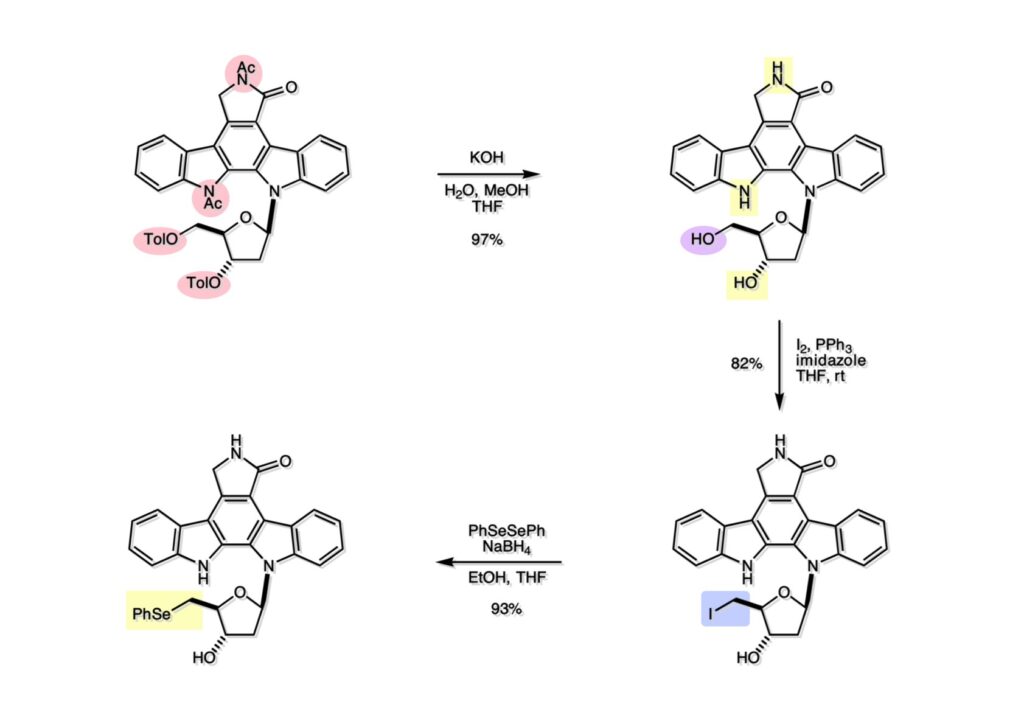
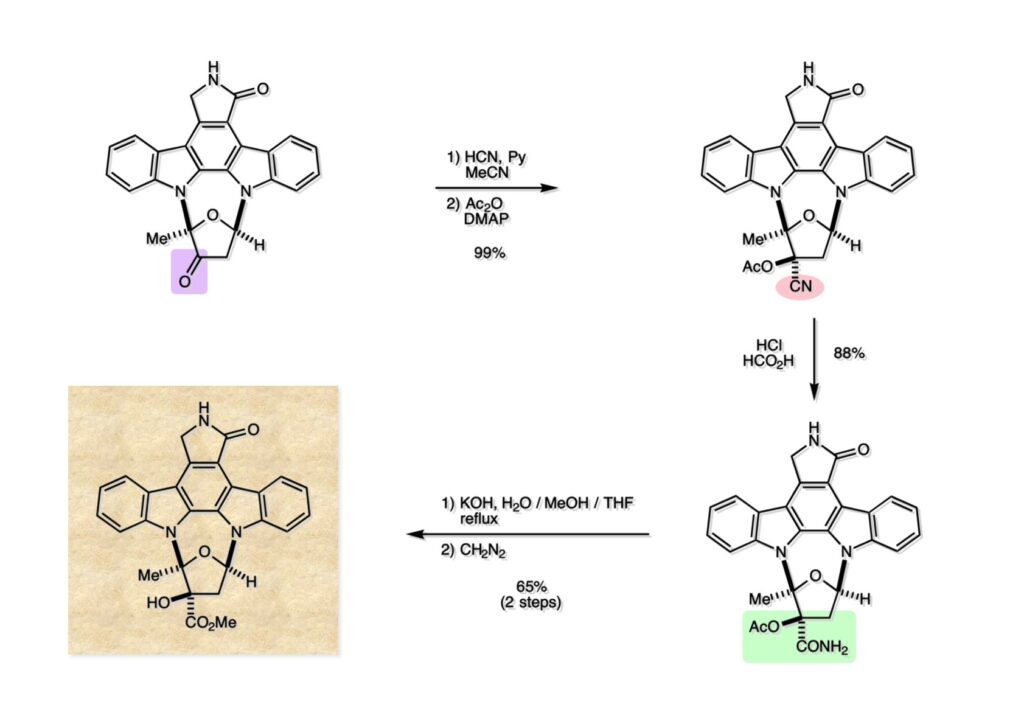
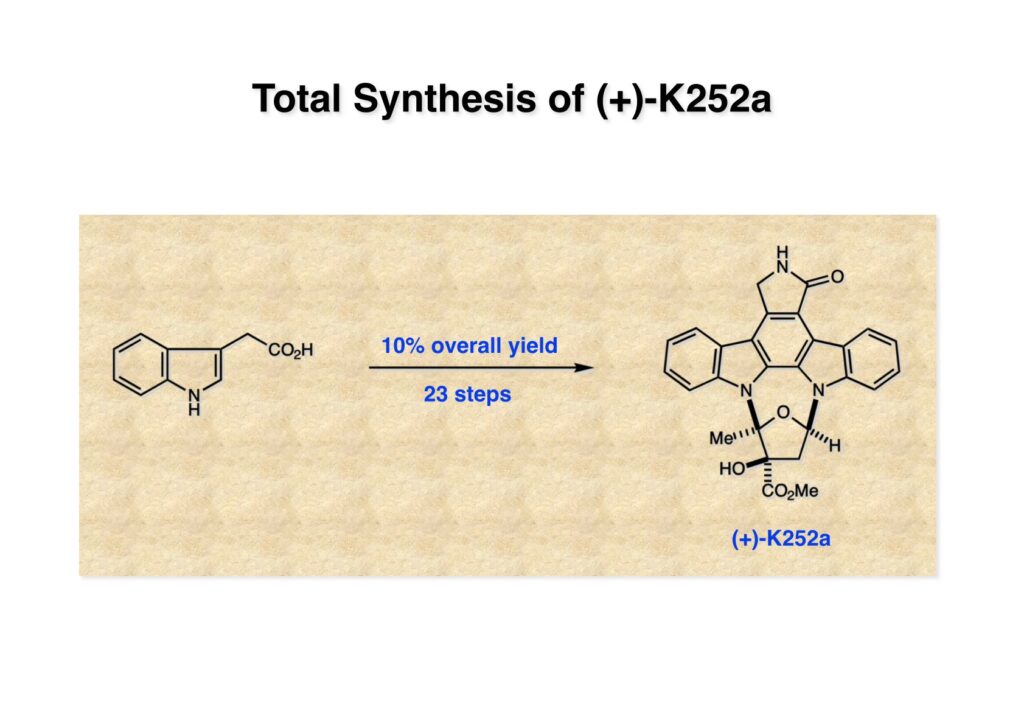
K252a (1-1) は staurosporine (1-2) に代表されるインドロカルバゾール骨格を有するアルカロイドのひとつで、特徴的な環状のグリコシド構造を有することや、極めて強力なプロティンキナーゼCの阻害活性を有することから注目を集めた化合物である。協和発酵で単離構造決定されたので当時コンサルタントだった私も興味を持っていた。また、少し前にライス大学でインドールの新規合成法を開発していたので、それを適用しようと全合成経路を考えていた。修士課程を古賀研で終えた小林義久君に全合成を頼み、途中で学部生だった藤本哲平君にも手伝ってもらって完成させた。糖を扱うのは初めての経験で、ちょっと物珍しさも手伝って行ったプロジェクトだった。
“Stereocontrolled Total Synthesis of (+)-K252a,” Y. Kobayashi, T. Fujimoto, and T. Fukuyama, J. Am. Chem. Soc., 121, 6501 (1999).