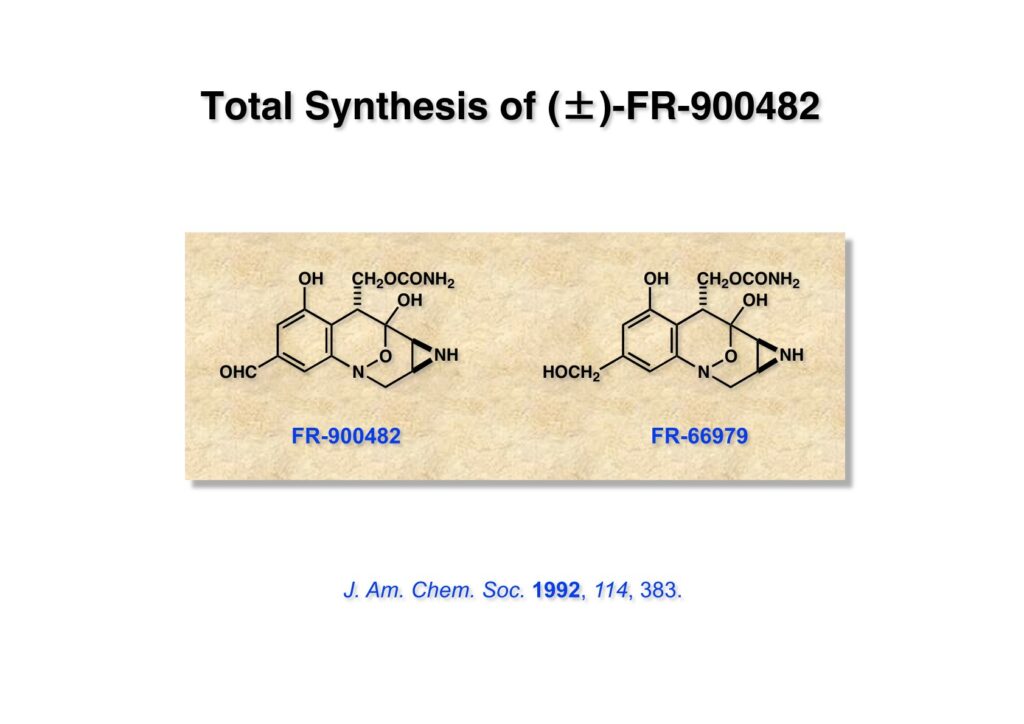
FR-900482は藤沢薬品で単離構造決定された抗腫瘍活性を持つ化合物で、マイトマイシンCと似た作用機構を持つが毒性が比較的低いということで、上市がが期待されたが結局薬にはならなかった。藤沢薬品から五島俊介さんという研究員がライス大学に派遣されたので、FR-900482の全合成を始めることにした。マイトマイシンCとは違った合成上の困難さがあり、なかなか短工程化が出来なかったのが悔しいところである。ただ、最初の全合成に成功したことで、最終工程近くでの中間体の不安定さや微妙な条件が必要だということを示せたのは、後から全合成を達成した人たちに貴重な情報を与えたと思う。
“Total Synthesis of (±)-FR-900482,” T. Fukuyama, L. Xu, and S. Goto, J. Am. Chem. Soc. , 114 , 383 (1992).
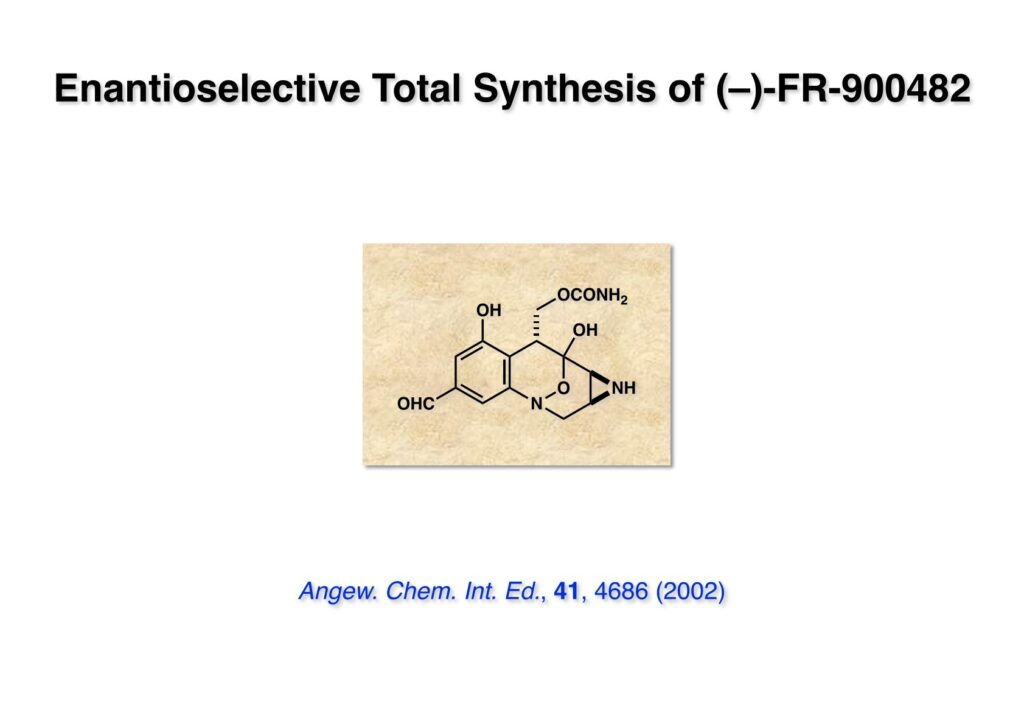
“Facile Construction of N -Hydroxybenzazocine: Enantioselective Total Synthesis of (+)-FR900482,” M. Suzuki, M. Kambe, H. Tokuyama, and T. Fukuyama, Angew. Chem. Int. Ed. , 41 , 4686 (2002).
“Synthetic Approaches Toward FR-900482. I. Stereoselective Synthesis of a Pentacyclic Model Compound.,” T. Fukuyama and S. Goto, Tetrahedron Lett. , 30 , 6491 (1989); “Intramolecular 1,3-Dipolar Cycloaddition Strategy for Enantioselective Synthesis of FR-900482 Analogues,” M. Kambe, E. Arai, M. Suzuki, H. Tokuyama, and T. Fukuyama, Org. Lett ., 3 , 2575 (2001); “Enantioselective Total Synthesis of FR900482,” M. Suzuki, M. Kambe, H. Tokuyama, and T. Fukuyama, J. Org. Chem. , 69 , 2831 (2004); “Total Syntheses of FR900482,” H. Tokuyama, M. Suzuki, and T. Fukuyama, J. Synth. Org. Chem. Jpn. , 65 , 470 (2007).
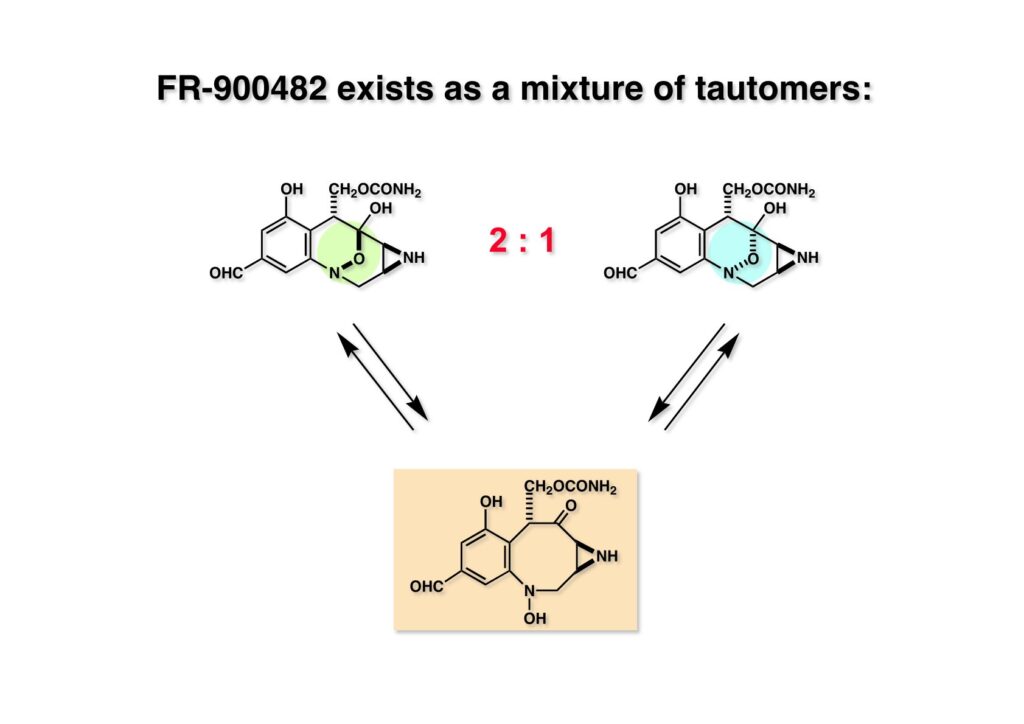
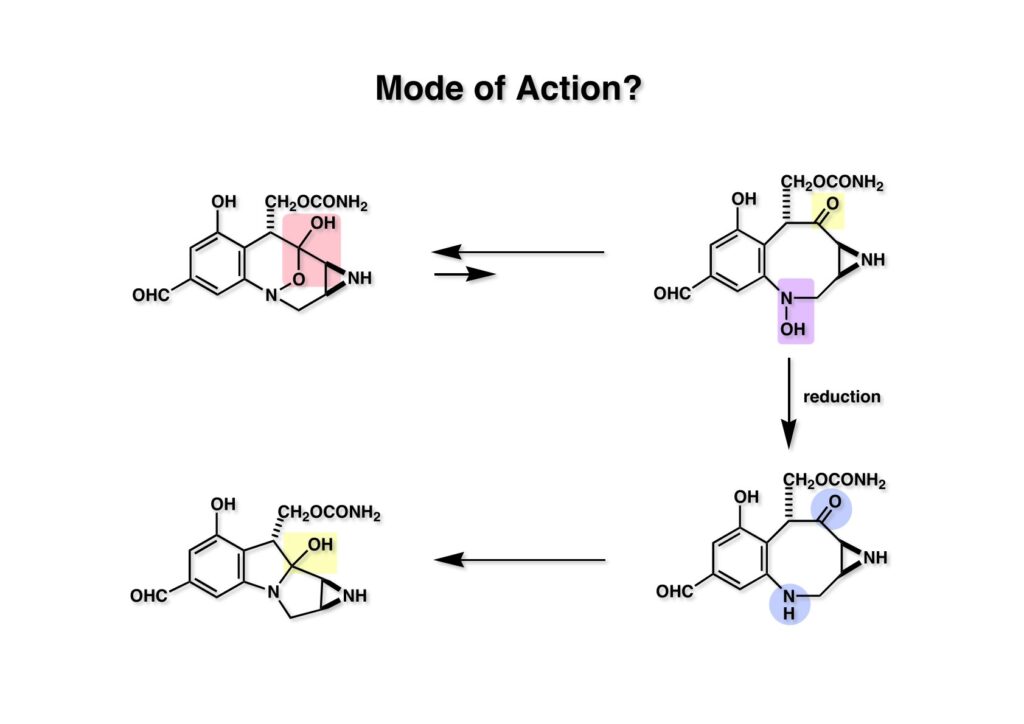
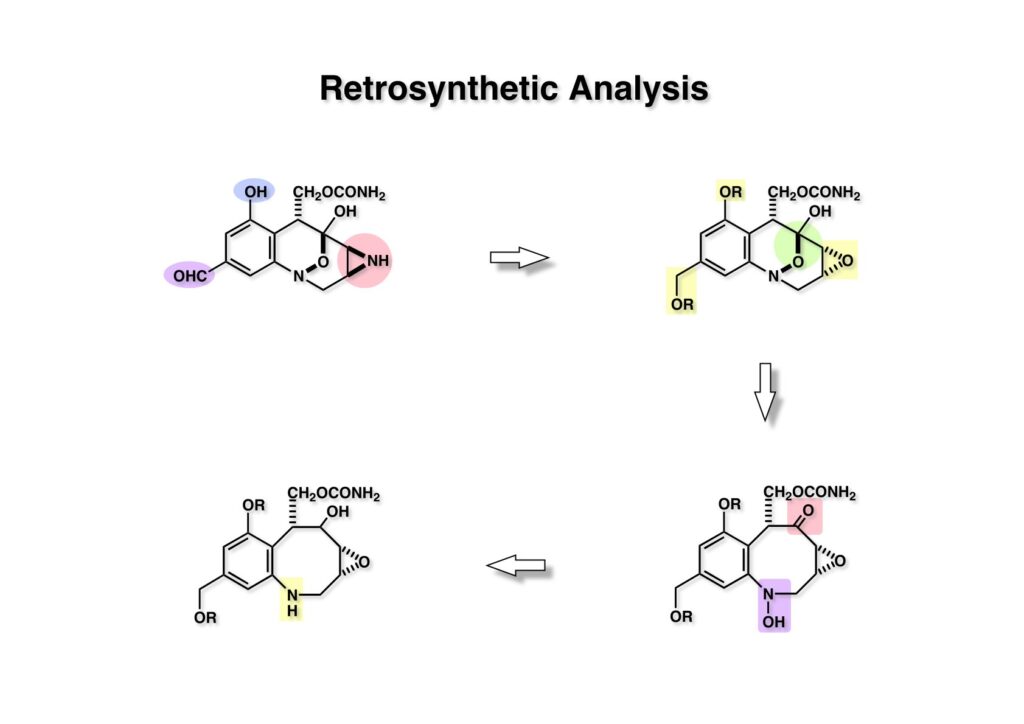
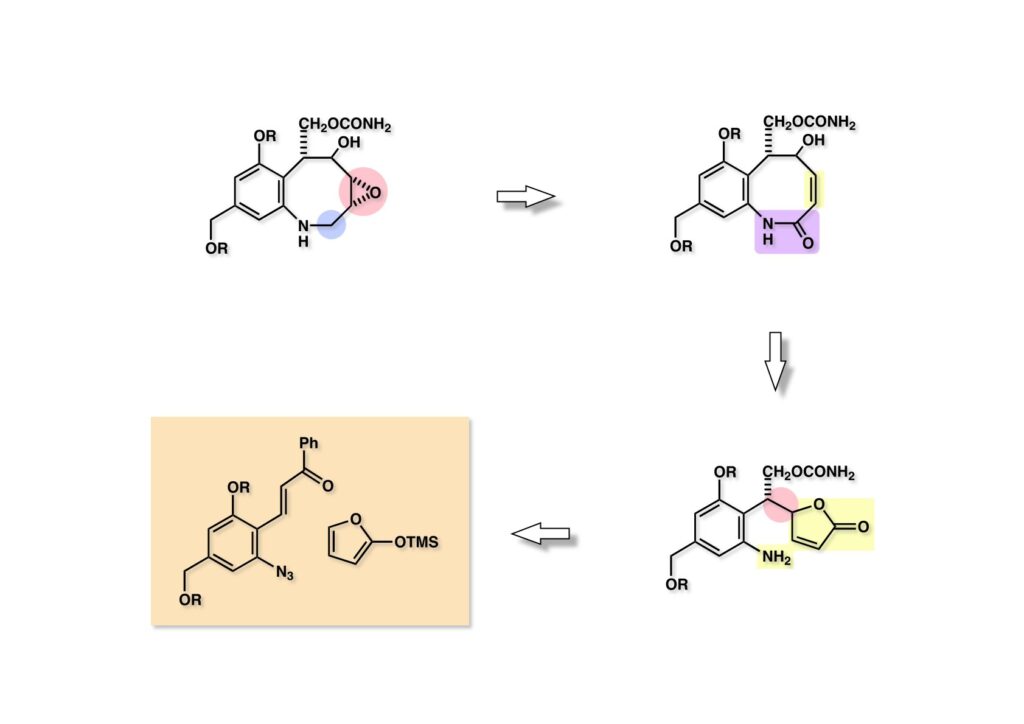
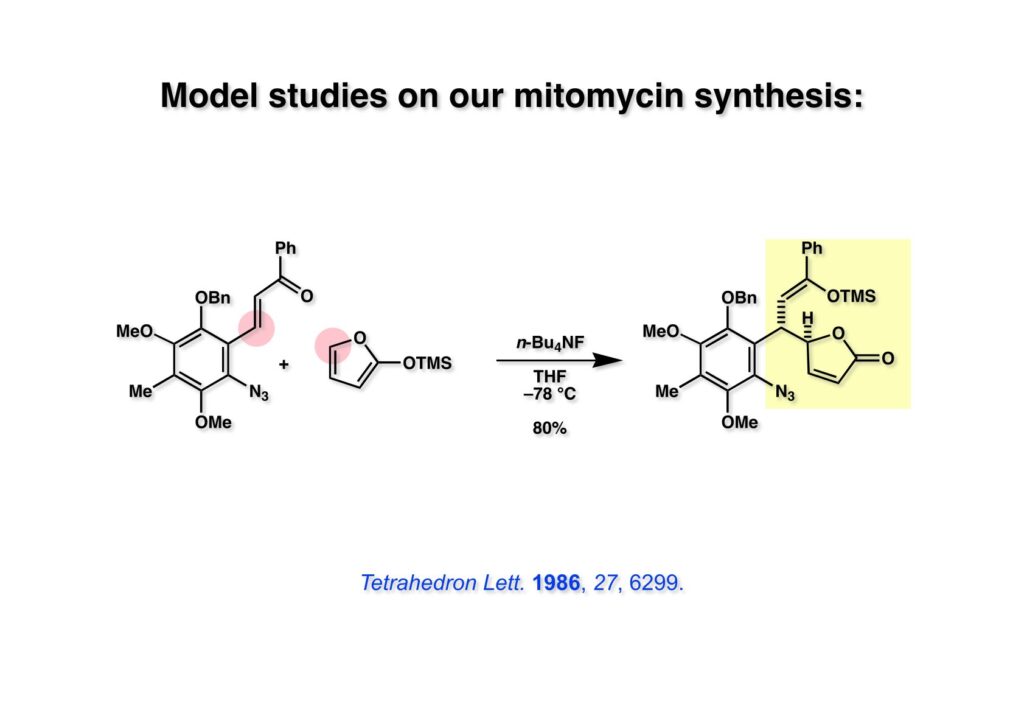
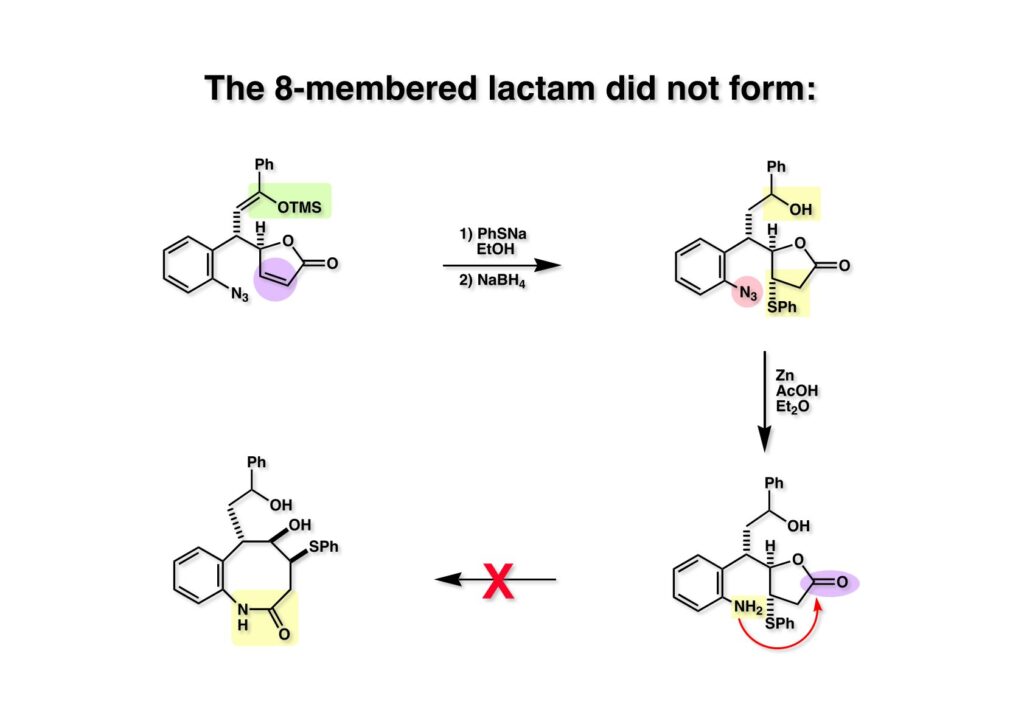
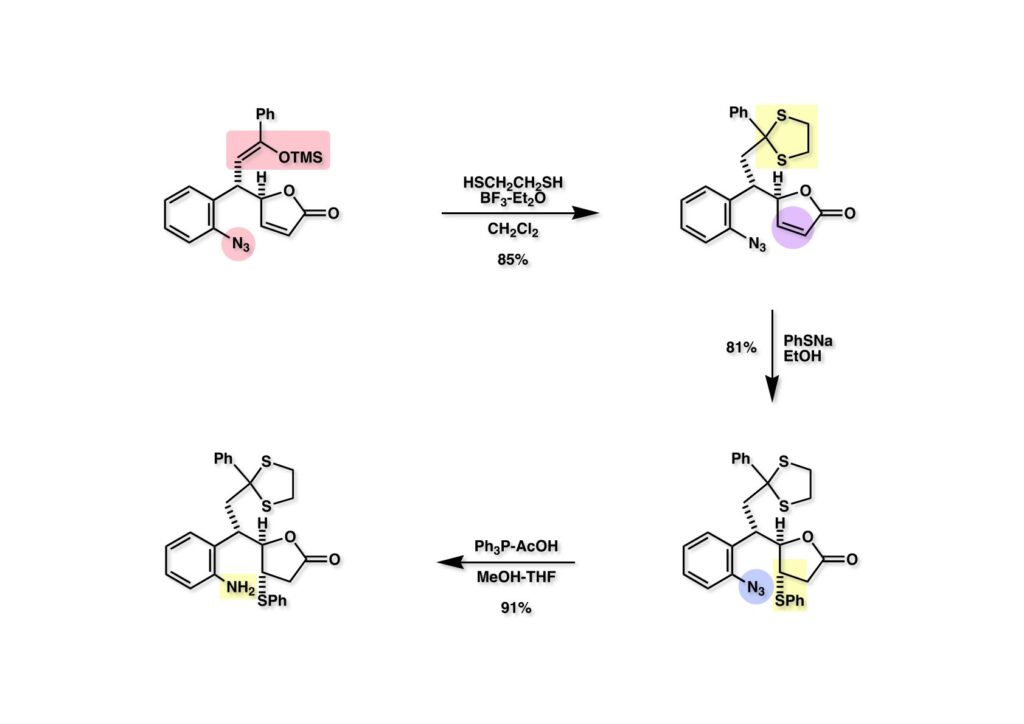
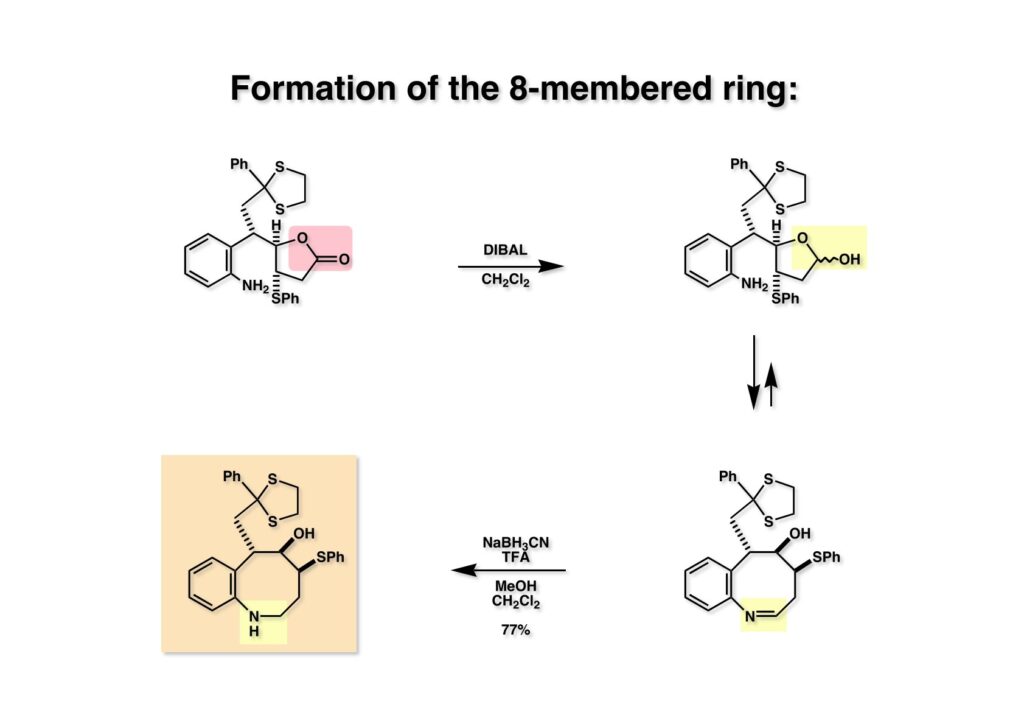
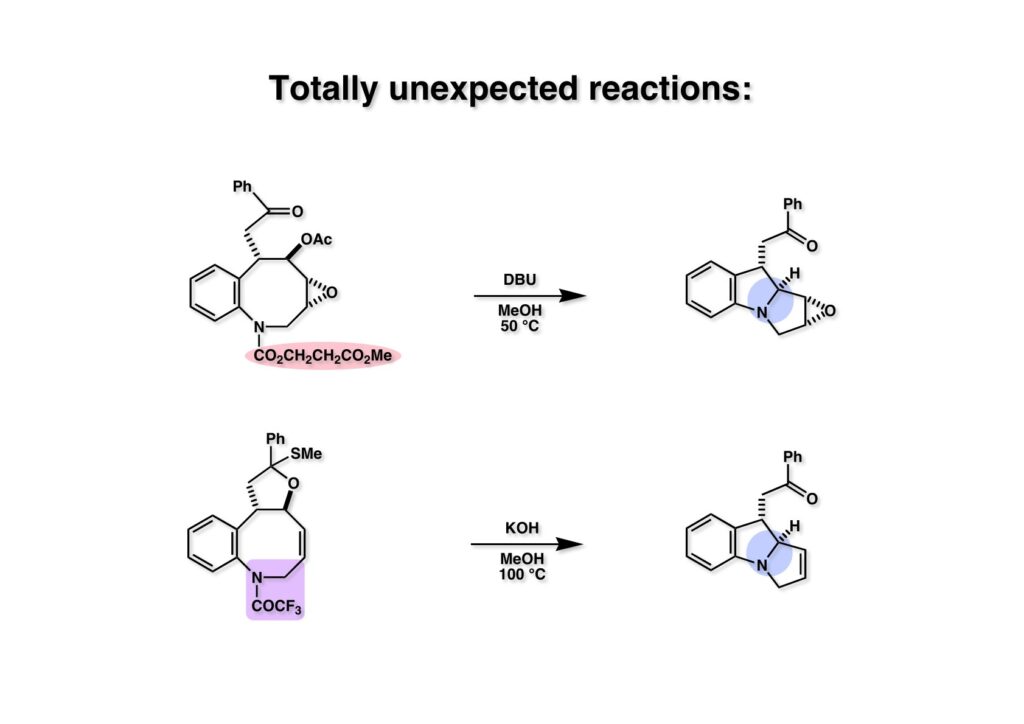
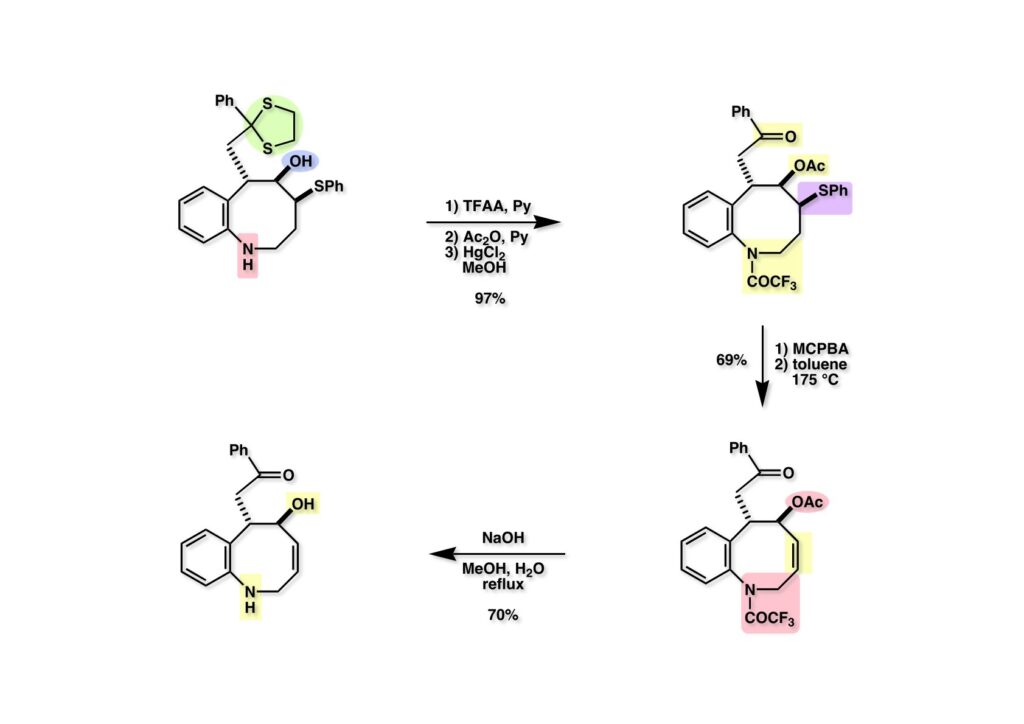
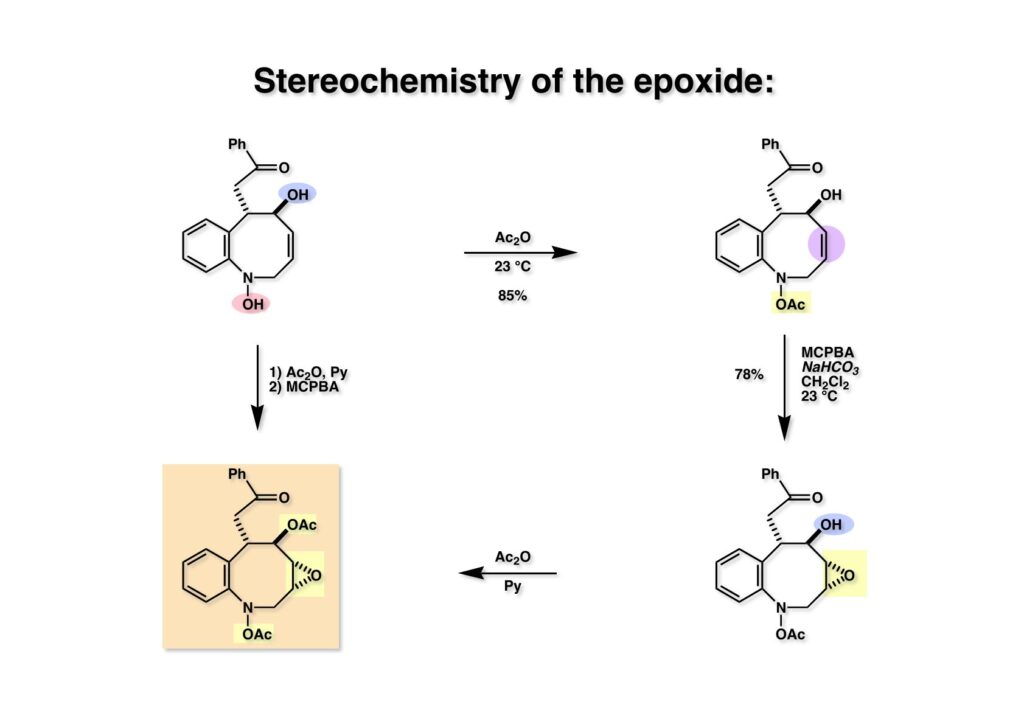
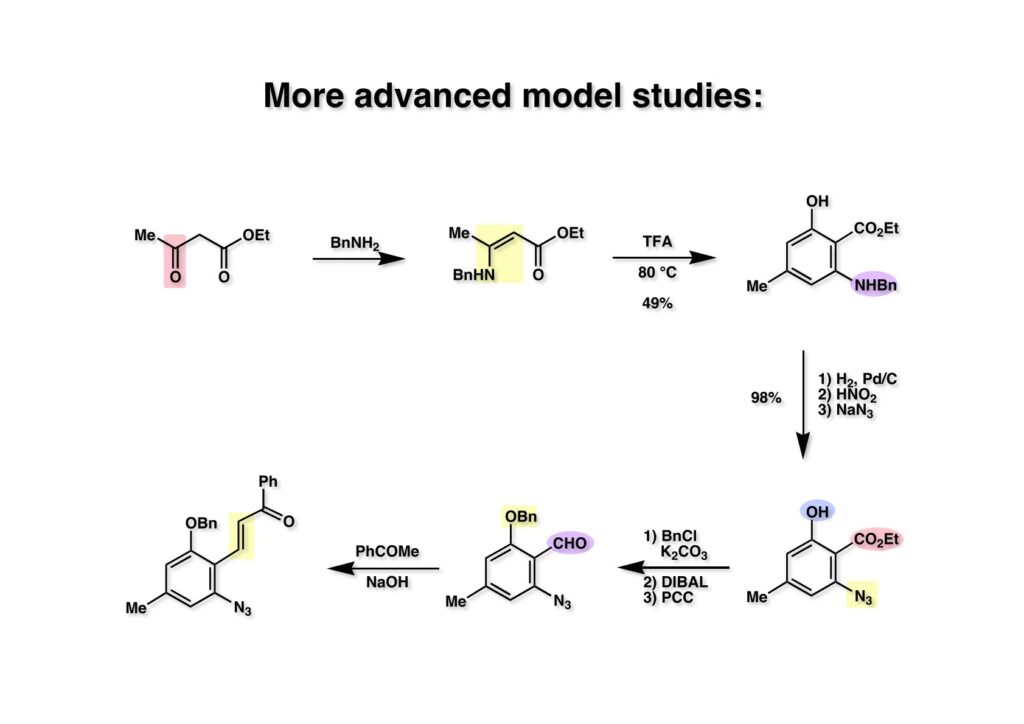
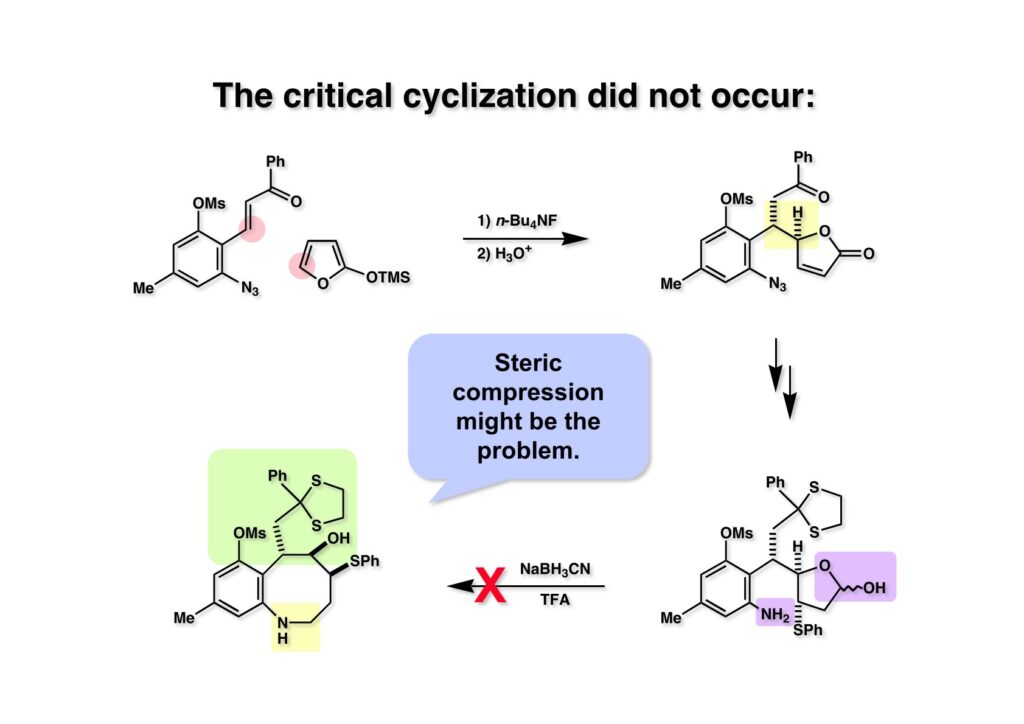
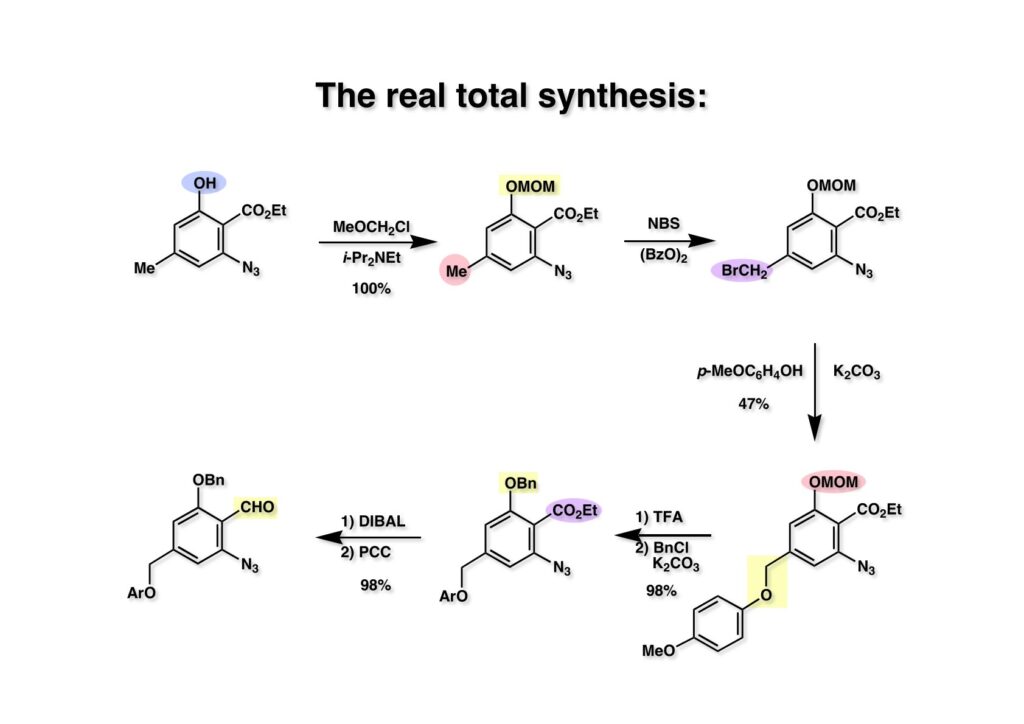
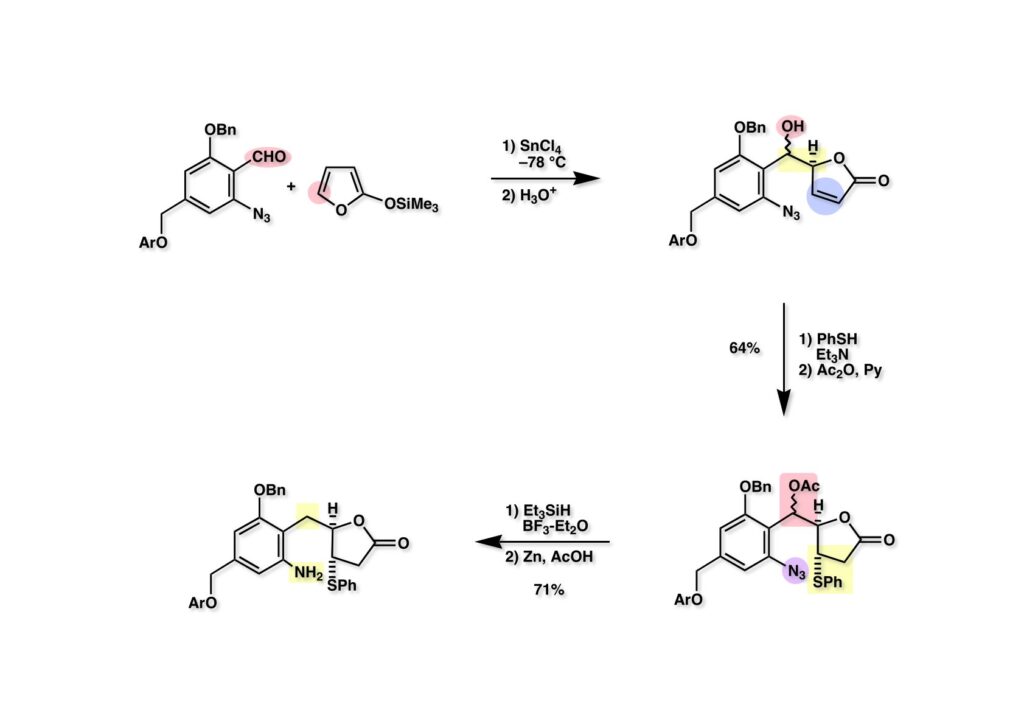
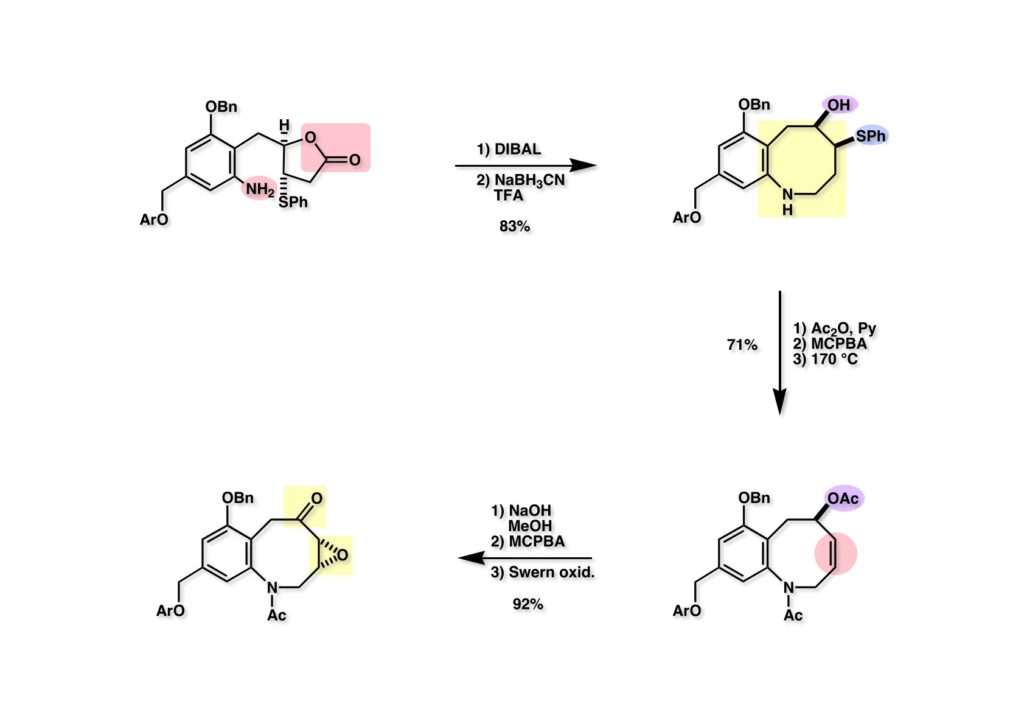
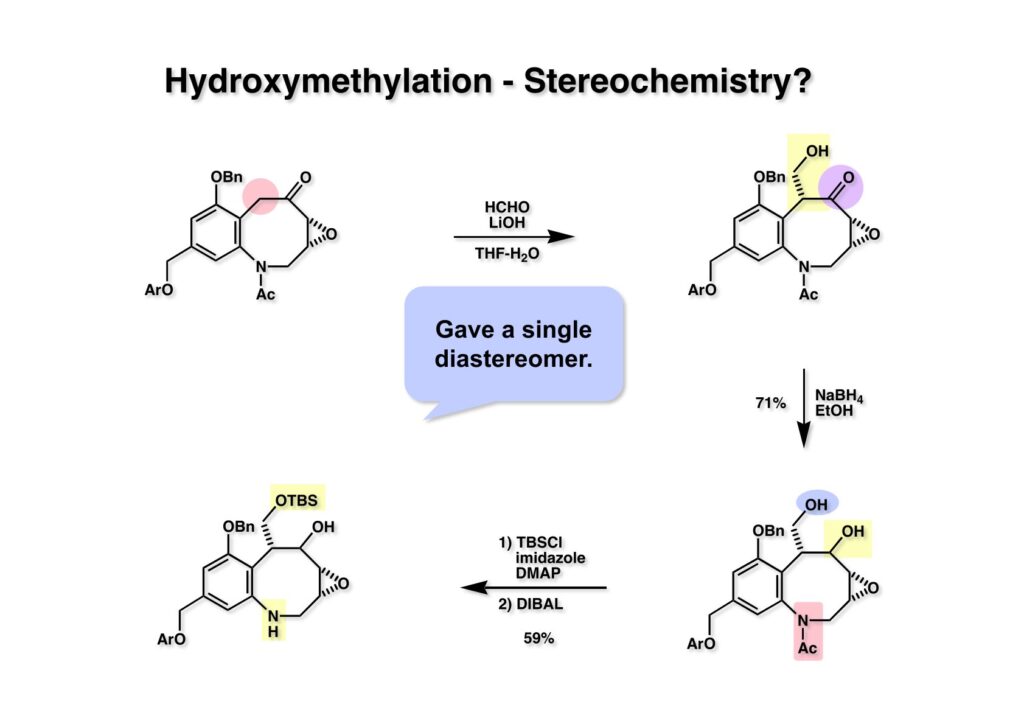
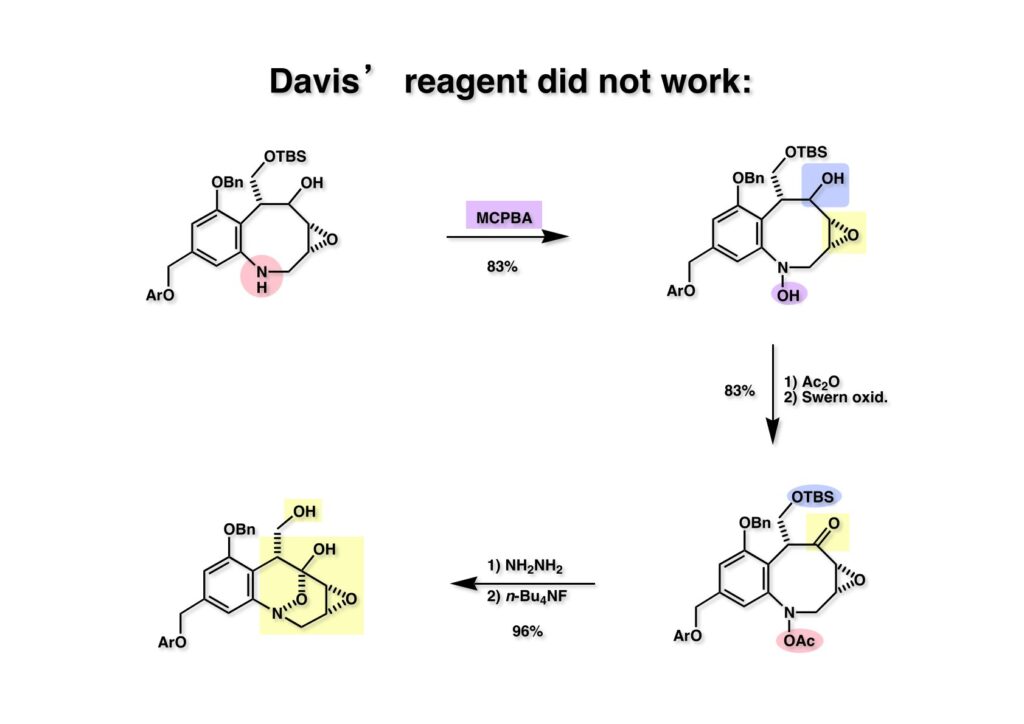
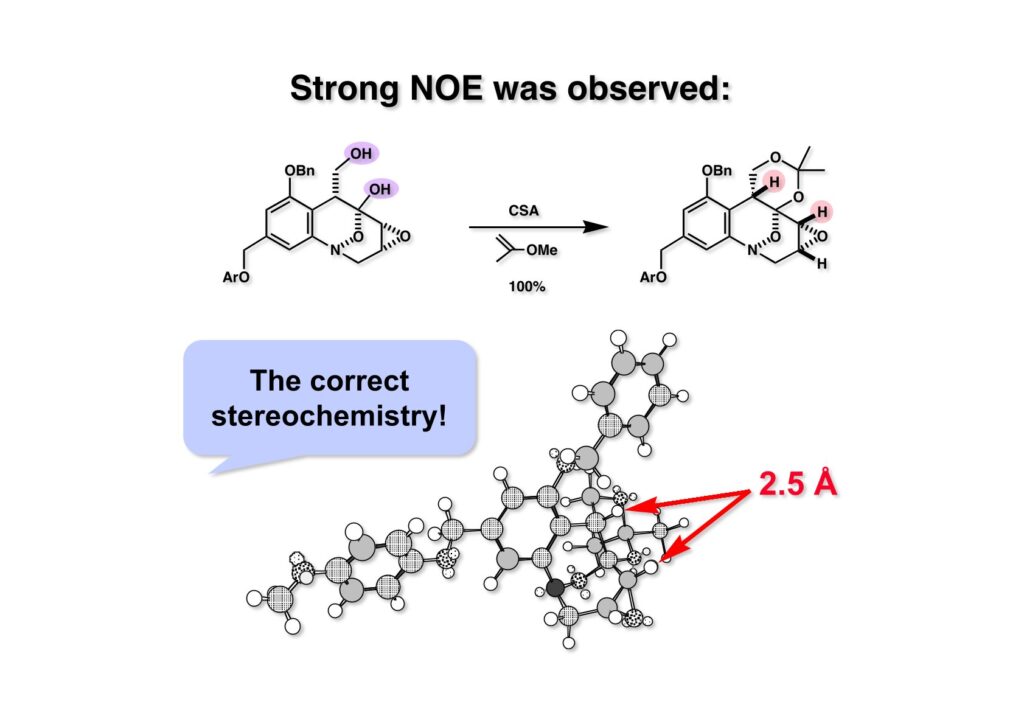
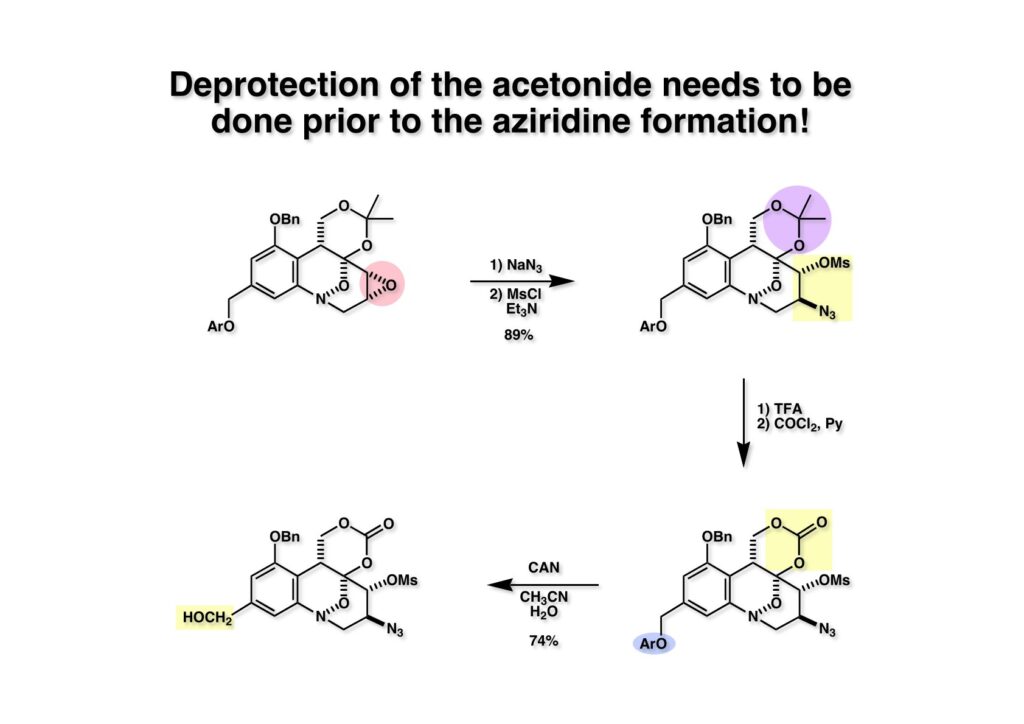
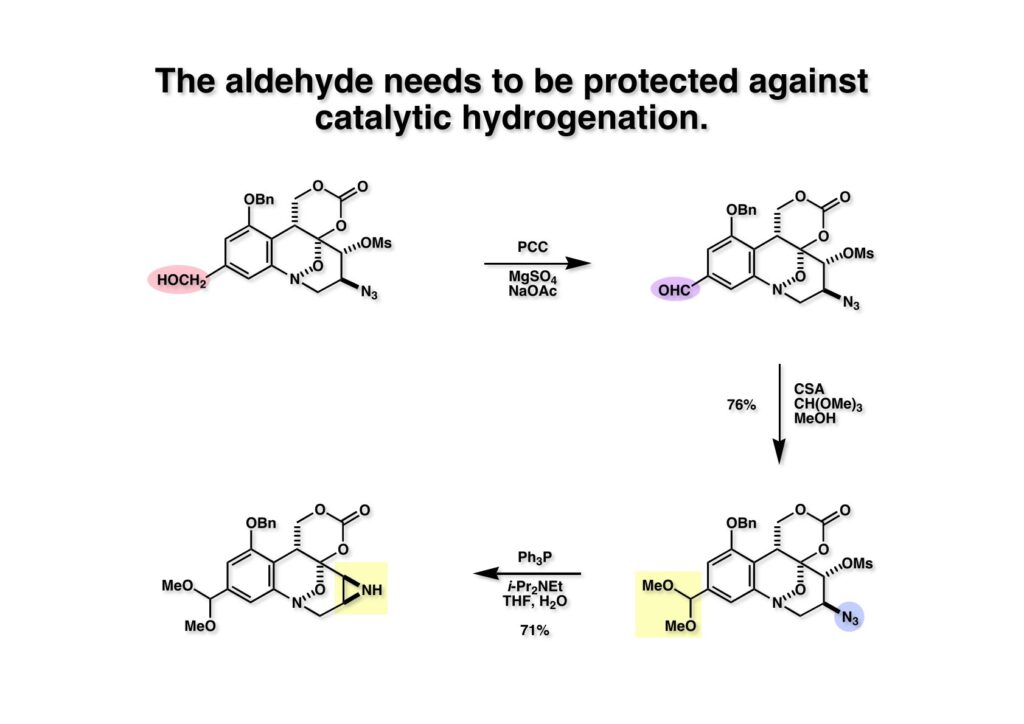
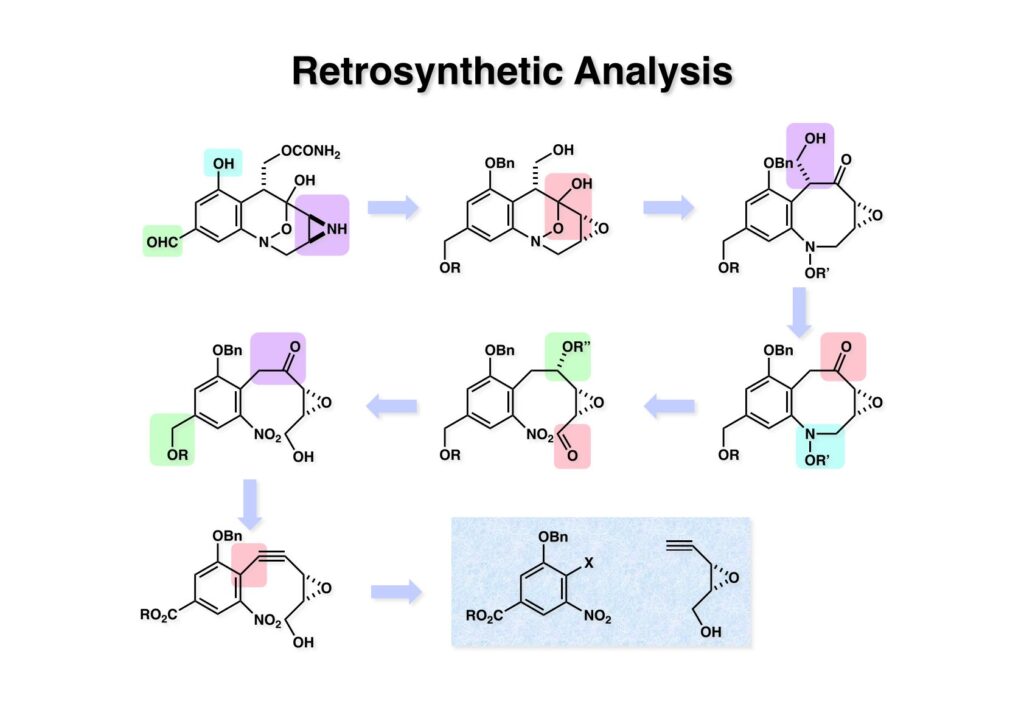
FR-900482のcongenerとして、FR-66979が同じく藤沢薬品から報告されている。両者はブリッジの開閉による平衡混合物として存在している。FR-900482の全合成に成功した時に測定した1H NMRはドヨーンとして、ガッカリするほど不鮮明であったが、トリアセチル体のNMRは鮮明であった記憶がある。 図のように、おそらくブリッジが開環した8員環中間体 (2-1) を経由して (1-1) と (1-2) は平衡関係にあると思うが、8員環化合物の存在は確認されていない。 FR-900482 (1-1) の生体内での作用機構は (1-2) のような8員環のヒドロキシルアミンが還元を受け、(2-2) が直ちに閉環して不安定なヘミアミナール (2-1) を生成する。 ヘミアミナール (1-1) は容易に脱水して、アジリジノマイトセン体 (1-2) を形成し、この活性種がDNAのdouble strandをアルキル化して細胞増殖を阻害すると考えられる。 還元過程こそ違うがFR-900482もマイトマイシンCも活性種となるには還元が必要である点がプロドラッグと言える。 FR-900482の構造はマイトマイシンC (MMC)の構造と共通点が多いため、逆合成解析はMMCの全合成中に蓄積した知見を元にして行った。まず、(1-1) のフェノールとアルデヒドを保護し、アジリジンの構築はエポキサイドから行うことにして (1-2) に導いた。(1-2) のブリッジを開環すると (2-2) となるが、ヒドロキシルアミンはアミンを酸化して合成することにし、渡環反応をブロックするためにケトンはアルコールにしておくとすると (2-1) が中間体の候補となる。 (1-1) のエポキサイドは (1-2) のα,β-不飽和ラクタムへの過酸化水素類のMichael付加を実現させれば良い。ここで (1-2) の水酸基とカルボニル基を巻き直すと (2-3) のようなブテノライドとなる。(2-3) はMMC全合成の初期実験に用いた反応を参考にして、カルコン (2-1) とフラン体 (2-2) のMichael反応で構築できることが予見される。 これがMMC全合成の初期段階で行ったMichael反応で、FR-900482合成に必要な要素が揃っている。 まず、簡単なモデル実験を行うこととし、カルコン (1-1) とフラン (1-2) のMichael反応で (1-3) を合成した。この付加体を用いて (2-2) まで合成したルートを紹介する。 前ページで合成したブテノライド (1-1) の二重結合にアミンがMichael付加しないようにチオフェノールを付加し、さらに生じたケトンも還元して (1-2) を得た。次にアジドを亜鉛還元してアミン (2-2) に導いた。ところが、このアミンから加熱やMe3Alを用いて8員環ラクタム (2-1) に巻き直そうとしたが失敗に終わった。 次の計画は分子内還元的アミノ化を試みることだった。(1-1) をエタンジチオールを用いてチオケタール (1-2) に変換し、ブテノライドにチオフェノールを付加して (2-2) を得た。次にStaudinger反応でアジドをアミン (2-1) に還元した。 ラクトン (1-1) をDIBALで還元してラクトール (1-2) に変換すると、8員環イミン (2-2) との平衡混合物となり、これをNaBH3CNで還元すると目的とする8員環アミン (2-1) が得られた。 次に、エポキサイドを構築するために、まずアミンをMeOCO基で保護し、水酸基はアセテートとし、更にチオケタールを常法によりHgCl2を用いて脱保護するとケトン体 (1-2) が得られた。(1-2) を1当量のMCPBAで酸化し、得られたスルホキシドを170度に加熱分解してオレフィン (2-2) に導いた。このオレフィン (2-2) をラジカル補足剤存在下にMCPBA酸化するとエポキサイド (2-1) が単一物として得られた。8員環化合物の立体配座は置換基をエカトリアル配座にモデルを組むと、どちらの面が立体的にオープンになっているかを予測することができる。 ここでは、8員環化合物が如何に渡環反応を起こしやすいかの例を示しておく。(1-1) のアミン保護基をretro-Michael反応で脱保護しようと、メタノール中でDBUと反応させたところ、(1-2) が得られてきた。アセテートでする脱離基となった例である。次の例は (2-1) のトリフロロアセチル基をKOH/MeOHで加メタノール分解しようと試みたところ、得られた生成物は (2-2) であった。このような反応は以前に経験したことがなく、非常に驚いた記憶がある。 すでに紹介済みの反応を経て得られた (2-2) を加水分解したところ、今度は首尾よく8員環アミン (2-1) に変換することができたので、この化合物を使って先に進むことにした。 2級アミンを酸化してヒドロキシルアミンに変換する方法はそれほど多くは知られていない。(1-1) の酸化ではDavis試薬 (1-2) が一番良い結果を与え、望むヒドロキシルアミン (1-3) が高収率で得られた。次いで、酸性度の大きいヒドロキシルアミンを無水酢酸のみでアセチル化し、次にアリルアルコールをSwern酸化してケトン体 (2-3) を得た。続くアセテートの加水分解条件では望む渡環体 (2-2) と脱酢酸後に環化脱水してフラン化した生成物 (2-1) との混合物が得られてしまった。 前ページで得られた (1-1) の二重結合を酸化して、エポキサイドかアジリジンかに変換する努力を行ったが (1-2) から (2-1) への変換は成功しなかった。 そこで、8員環のうちに二重結合をエポキサイドに変換することを試みた。まず、(1-1) のヒドロキシルアミンをアセチル化で保護し、得られたアセテート (1-2) をMCPBAで酸化したところ望むエポキサイド (2-2) が得られた。環状アリルアルコールの過酸によるエポキシ化にはHenberst則が知られている。つまり水酸基と同じ側から優先してエポキシ化が起きるというルールであるが、8員環アリルアルコールにはこのルールは適用できない。(2-2) の水酸基をアセテートで保護して (2-1) が得られた。 (1-1) の水酸基をSwern酸化でケトンに変換し、アセテートをヒドラジン処理で外したところFR-900482 (2-1) 様の骨格を持つエポキサイド (1-2) が得られた。これをもってモデル実験は終了し、FR-900482の全合成に着手した。 今はSciFinderを使ってお茶の子さいさいで化合物が検索できるが、昔はChemical AbstractsのCollective Indexを用いて賢い探し方をしないと良い化合物は見つからなかった。そういう意味で、出来る学生を図書館に送れば、そんなに時間をかけなくても良い調査結果を持って帰ってくるが、出来ない学生を送り込むといつまで待っても戻ってこない、というところで学生の評価が分かれるのであったが…。SciFinderの検索でも上手な学生は良質な情報を探してくるが、下手な学生は玉石混交で何でも引っかかる物を集めてくる。この辺りにもセンスというものが問われるのだ。昔、よく学生に言っていたが、教師は有機化学の基本を教えることは出来るが、「センスは教えられない」ってね。ところで、このページの反応はベンジルアミンでなく、プロピルアミンを使っていた論文を見つけることができたのが元になっている。 カルコン (1-1) とフラン体 (1-2) のMichael付加は順調に進行し、シリルエノールエーテルの加水分解後に (1-3) を得た。モデル実験のルートを踏襲してラクトール (2-2) を合成し、還元的アミノ化を行って8員環化合物 (2-1) を得ようとしたが、目的物は得られなかった。モデル実験と違うのはオルト位にMsO基が存在しているだけなので、立体的反発によって中間体イミンが形成されなかったと思われる。このように、モデル実験でうまく行ったからと言って本番でうまくいくとは限らず、何のためにモデルを使ったのか分からないという事例が多々あるのが現実である。 さて、ここからはFR-900482の全合成につながったルートについて説明していく。まず (1-1) のフェノールをMOM基で保護し、得られた (1-2) のメチル基をNBSでブロモ化して (1-3) を得た。次いで、p -メトキシフェノールと炭酸カリでp -methoxyphenoxy基を導入した。得られた (2-3) のMOM基をTFAで外し、ベンジル化して (2-2) を得た。次にエステルのDIBALによる還元(LAHを使うとアジドが還元される)と続くPCCによる酸化でアルデヒド (2-1) に導いた。 ヒドロキシメチル基は後で導入することにしたので、カルコンは使わずにアルデヒド (1-1) にフラン体 (1-2) を付加させて (1-3) を得た。(1-3) のブテノライドの二重結合をチオフェノールの付加でブロックし、水酸基をアセチル化して (2-2) に変換した。ここでベンジル位のアセトキシ基をEt3SiH-BF3•Et2Oの条件で還元的に除去し、更にアジドを亜鉛で還元して (2-1) を得た。Et3SiH-BF3•Et2Oはカルボカチオンを還元する常套手段で、この場合はオルト位にベンジルオキシ基があるため簡単にベンジル位にカチオンが生成して還元が進行する。酸性条件で使える還元剤と言えばNaBH3CNがあるが、トリルフロロ酢酸中、メタンスルホン酸まで入れて還元に使ったことがある。 (1-1) のラクトンをDIBAL還元し、次にNaBH3CNとTFAで還元すると還元的アミノ化が進行して8員環アミン (1-2) が得られた。カルコン付加体由来の化合物では還元的アミノ化が進行しなかったので、やはりベンジル位の置換基とオルト位の置換基との立体反発に起因すると考えられる。(1-2) の水酸基とアミンをアセチル化し、スルホキシド脱離を行うとオレフィン体 (2-2) が得られた。更に (2-2) のアセテートを加メタノール分解した後にMCPBAで二重結合をα面からエポキシ化し、水酸基をSwern酸化すると (2-1) が高収率で得られた。 ケトン (1-1) とホルマリンでアルドール反応を行うと、NaOHを用いた場合に更に脱水して副生物のメチリデン体が無視出来なかったが、塩基をLiOHにすると副生物の生成はほぼ抑えられ、単一の生成物 (1-2) が得られた。この時点では相対的な立体配置は決まっていなかったが、分子モデルの考察から所望の配置を持っていると考えた。後に中間体のNOE実験からこの立体配置が証明されている。不安定な (1-2) はケトンをNaBH4還元してジオール体 (2-2) に変換した。ここでも生成物は単一物であったが、二級アルコールはケトンに酸化するので、立体化学は決めていない。(2-2) の一級アルコールを選択的にTBS化し、アセトアミドをDIBALで部分還元することでアミン (2-1) を得た。 次にアミン (1-1) をDavis試薬でヒドロキシルアミンに酸化しようと試みたが、モデル化合物ではスムーズに酸化できたのに (1-1) は酸化できなかった。そこで、過剰酸化を心配しながらMCPBAで酸化したところ、高収率で望むヒドロキシルアミン (1-2) が得られた。次に、ヒドロキシルアミン (1-2) を選択的にアセチル化後、二級アルコールをSwern酸化してケトン (2-2) を得た。(2-2) のアセテートをヒドラジンで外し、TBAFでTBS基を除去すると渡環したジオール体 (2-1) が高収率で得られた。 ジオール (1-1) をアセトナイド (1-2) に変換してNOEを測定したところ、ピンクでマークしたプロトンに強いNOEが観測されて図のような構造が証明された。 エポキサイド (1-1) は比較的反応性が低く、過剰のNaN3を用いDMF中120度6時間加熱という条件で開裂が完了し、水酸基をメシル化して (1-2) を得た。先行実験でアジリジン構築後は酸性条件に非常に不安定で、アセトナイドもMPM基も外せないことが判明していた。そこで (1-2) のアセトナイドをTFAで外してからホスゲンを用いて環状カーボネート (2-2) に変換した。(2-2) のMPM基は含水アセトニトリル中でCANを作用させると一級アルコール体 (2-1) が (1-2) から通算収率74%で得られた。 (1-1) のベンジルアルコールをPCC酸化してアルデヒド (1-2) に変換した。芳香族アルデヒドは接触還元の条件で還元されやすいので、(1-2) はジメチルアセタール (2-2) として保護しておいた。次にアジドをPh3Pを用いてStaudinger反応を行ったところ、アジリジン (2-1) が直接生成した。 (1-1) のベンジルエーテルを加水素分解して定量的にフェノール (1-2) を得た。実はこのアセタールを通常の条件で加水分解しようとしたのだが、アジリジンが分解して目的物が殆ど取れなかった。最初の頃は (1-2) の塩化メチレン溶液と希塩酸を分液で振る操作で (2-2) を得ていたが、THF-H2O中で0.05当量の過塩素酸と室温でゆっくり反応させることで高収率で (2-2) が得られた。最終段階は環状炭酸エステル (2-2) をアンモノリシスすることでFR-900482の全合成を終えた。1H NMRスペクトルはドヨーンとしていて頼りなかったが、トリアセチル体 (FK973) に変換したところ天然物からのFK973とスペクトルが良い一致を示した。 全合成の最終段階でアンモニアを作用させれば目的物が得られるだろうという予想は、上記のモデル実験の結果から判断したものだった。すなわち、(1-1) のアルデヒドを還元すると、橋頭位にあったベンゾイル基が中間体 (2-2) を経由してヒドロキシメチル基の方へ移動したのだ。そこで、(3-1) にアンモニアを作用させると (3-2) を経てカルバメートは橋頭位の方ではなく、ヒドロキシメチル基の方に移るだろうと予測でき、実際にスムーズに所望の化合物が生成した。
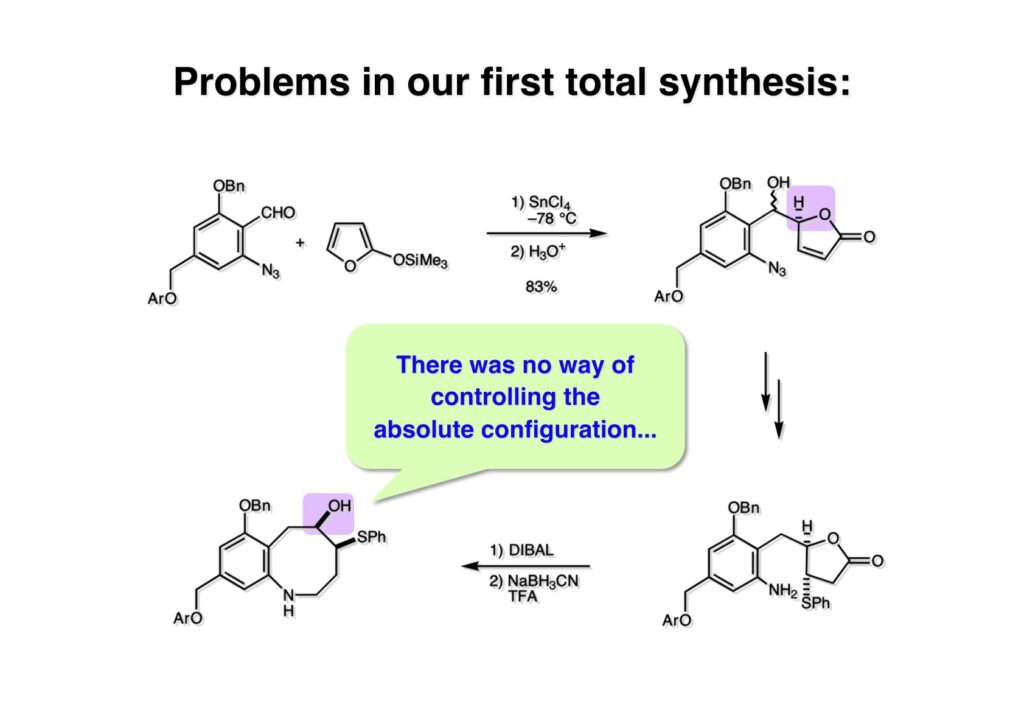
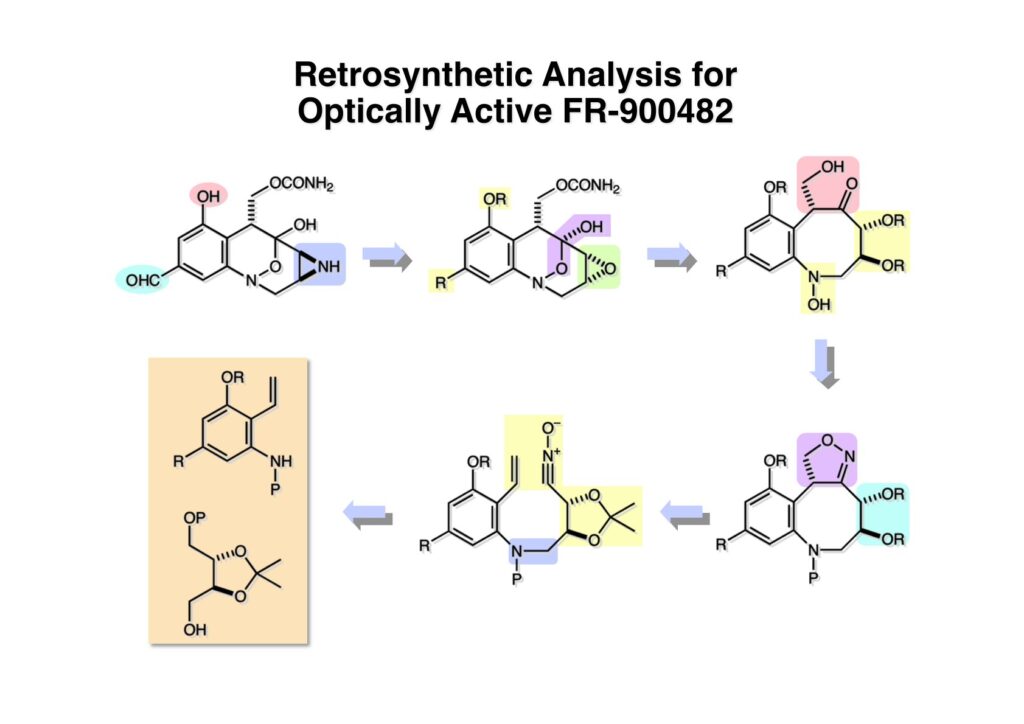
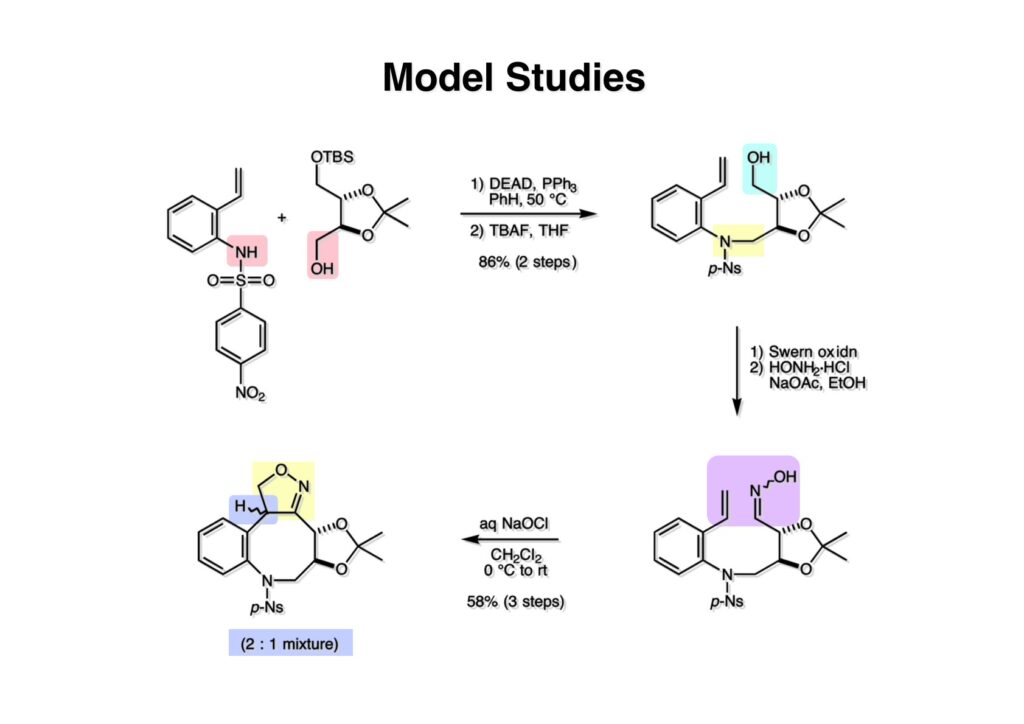
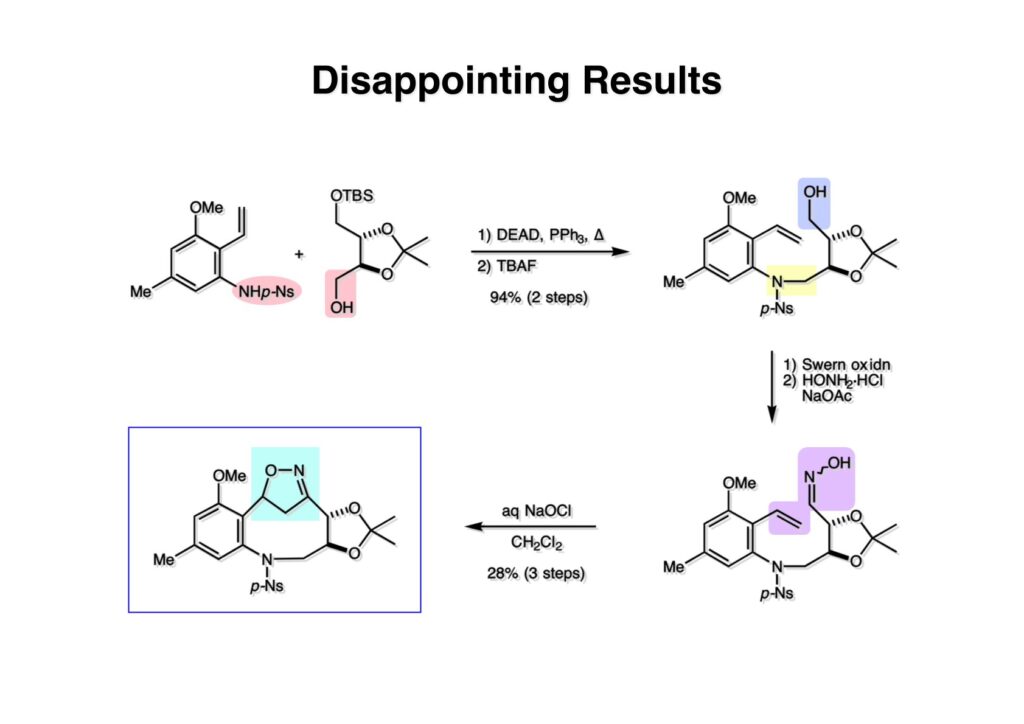
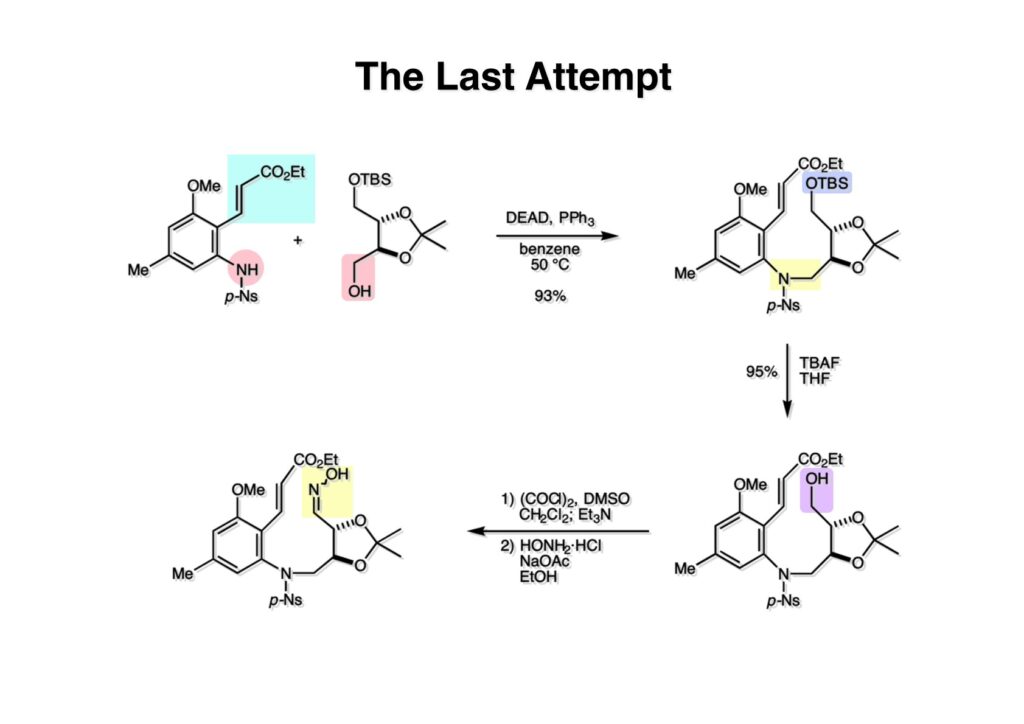
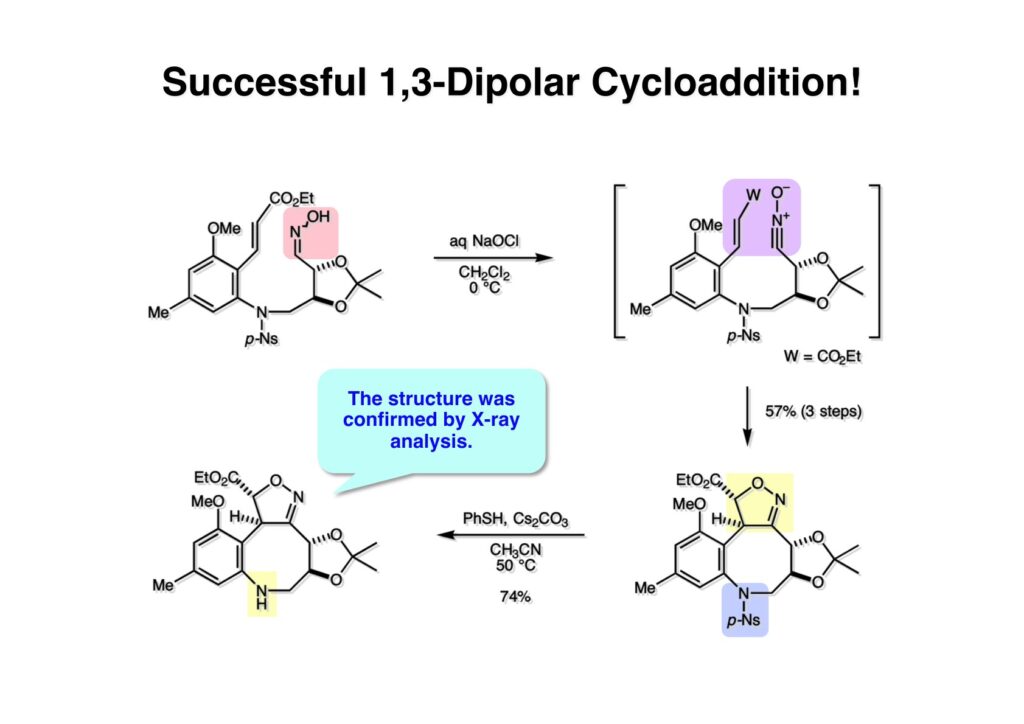
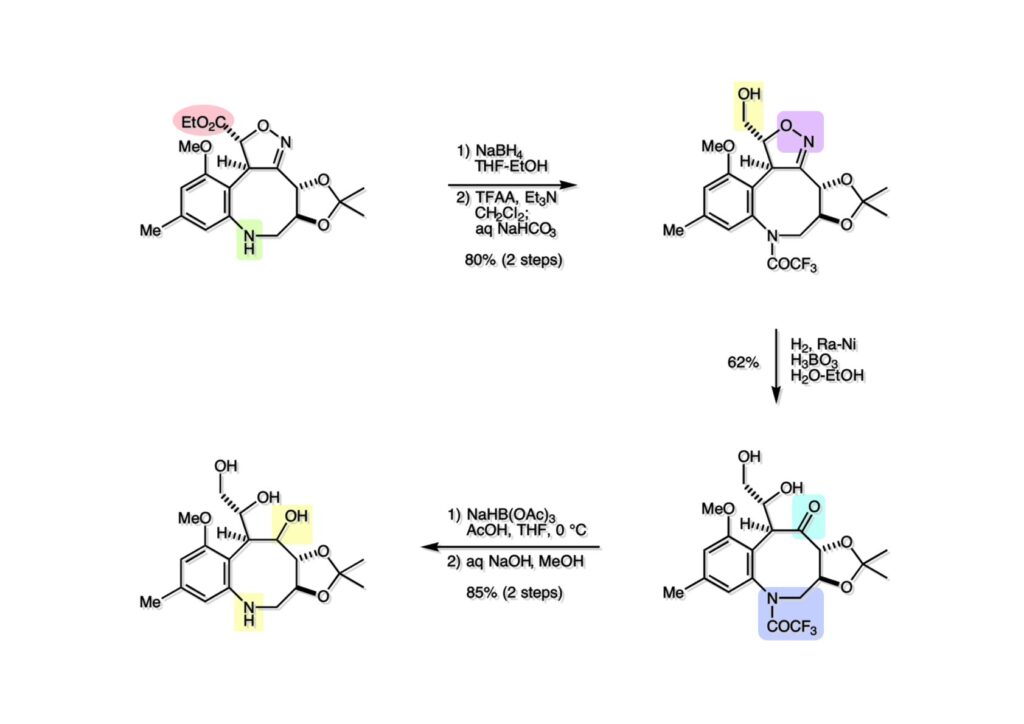
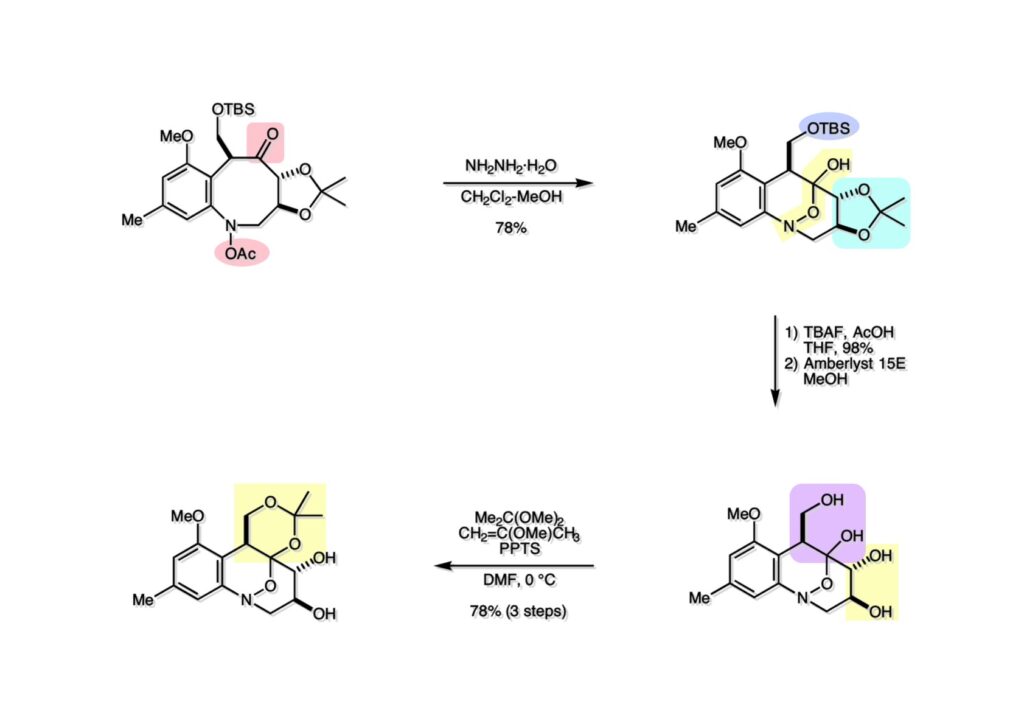
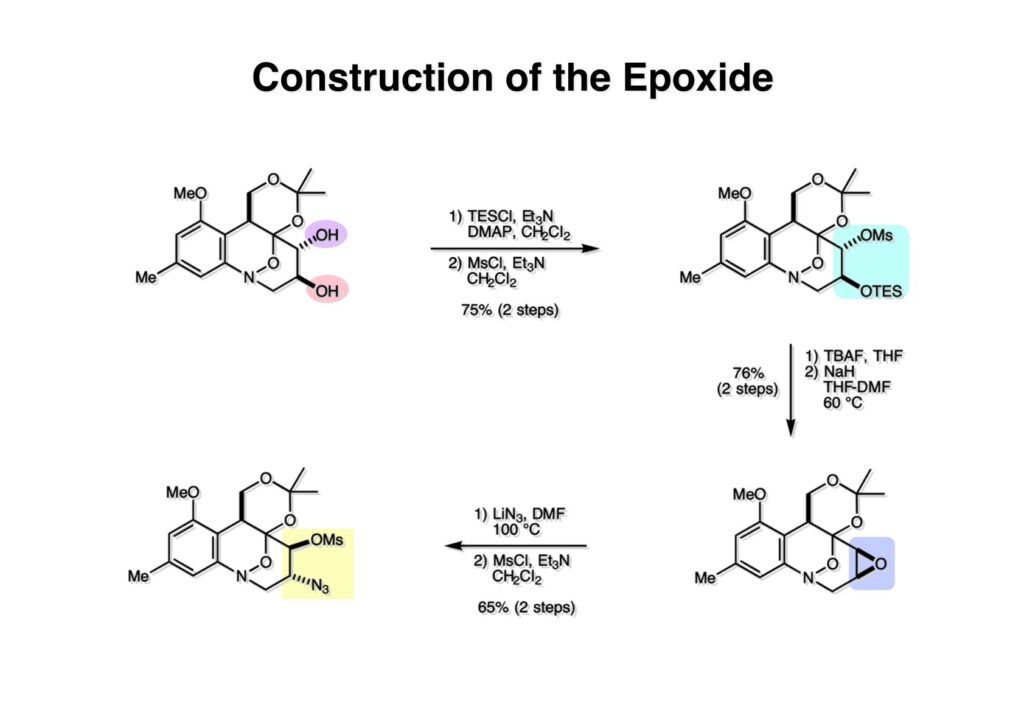
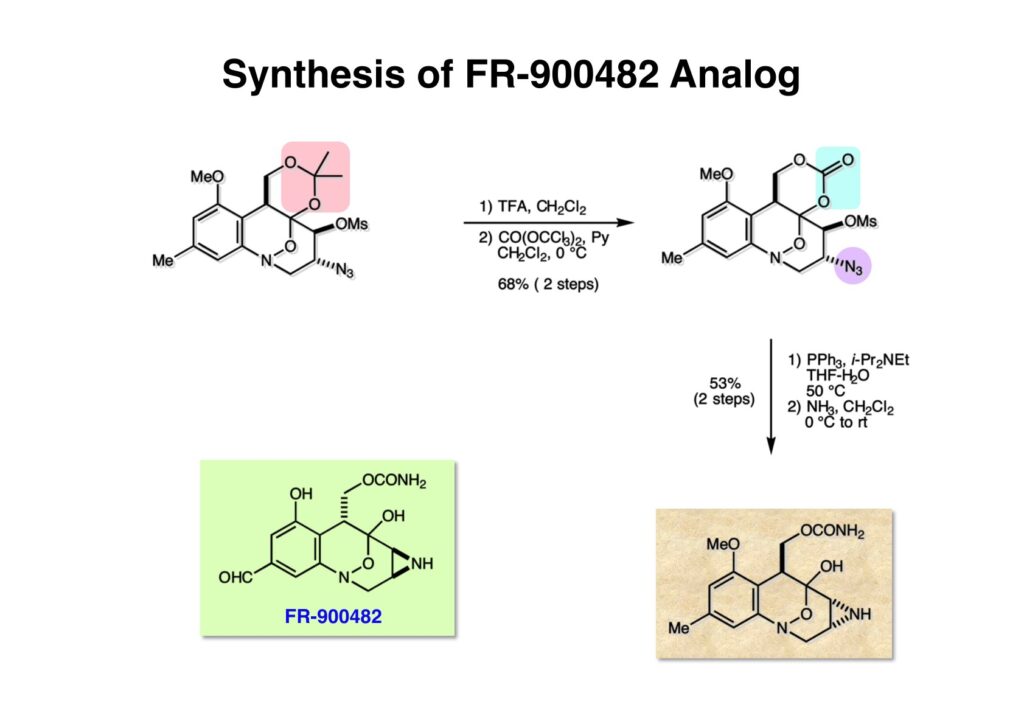
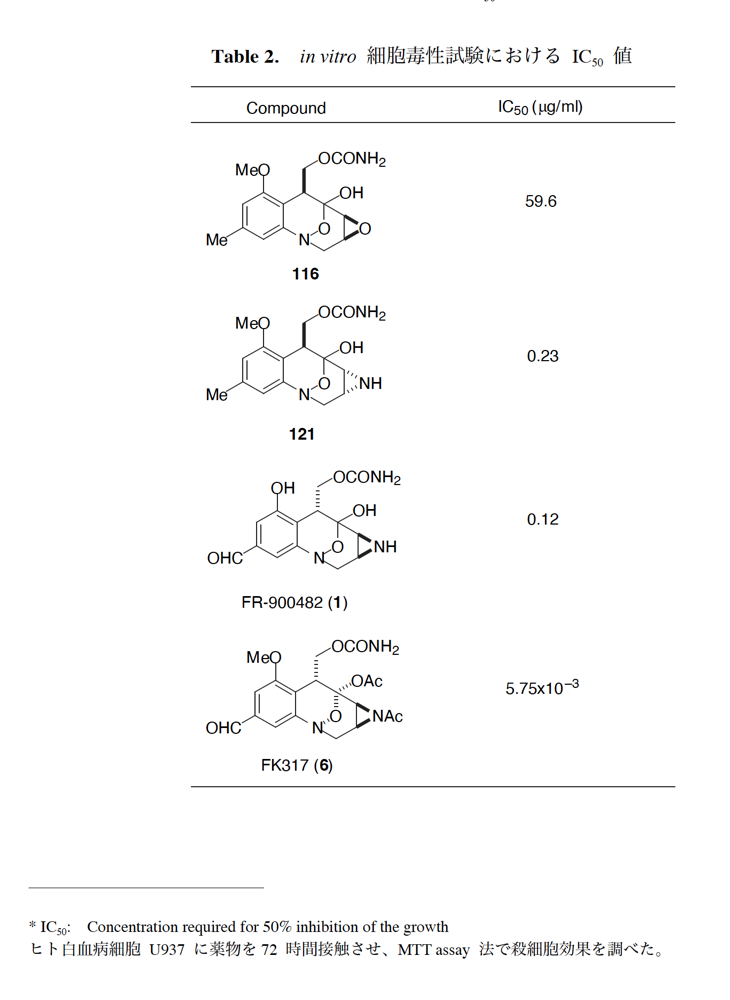
ライス大学でMMC合成をヒントにしたFR-900482の全合成を完成させたが、8員環構造をもっと違う方法で構築したいと思っていたので、東大着任後にモデル実験を開始した。今回の試みはFR-900482そのものの合成には至らなかったが、そういうアプローチもあるものだという事を示せたと思う。 最初の全合成ではフラン体 (1-2) のアルデヒド (1-1) への不斉付加が考えられなかったのでラセミ体合成になった。現在知られている不斉ルイス酸触媒を使えば不斉合成ができる可能性は高いかもしれない。 今回の逆合成の基幹となるのは、強力な1,3-双極子付加反応の代表的反応種であるニトリルオキシドを利用する事である。(2-2) の付加環化反応が成功すれば (2-3) となり、N-O結合の還元で所望の (1-3) に変換する計画だ。L-酒石酸由来のジオール (3-1) を用いれば光学活性なFR-900482の合成に導ける。 ノシル基の開発は別項の「反応開発」で解説するつもりだが、まだ全合成の項の解説に手いっぱいでそこまで手が回らない。ここでは初期に行ったモデル実験について記述するが、簡単に合成できるノシル体 (1-1) と酒石酸から誘導したアルコール体 (1-2) を光延反応でカップリングさせ、生成物のTBS基をTBAFで除去して (1-3) を得た。次に、水酸基の Swern酸化で生じたアルデヒドを常法でオキシム (2-2) に変換した。このオキシムを次亜塩素酸ソーダで酸化して生じたニトリルオキシドは、首尾よく1,3-双極子付加反応が進行して付加体 (2-1) を2:1のジアステレオマー混合物 (2-1) を58%の収率で与えた。ここでは立体化学を特定していない。なお、p -ノシル体では58%、o -ノシル体では30%の収率だったため、通常はアミンの活性化に優先的に用いないp -ノシル体を使うことにした。 次はオレフィンのオルト位に置換基を持つモデル化合物を使って1,3-双極子付加反応を行うことにした。FR-900482の全合成に用いた中間体 (1-2) のフェノールをメチル化して (1-3) にし、更にエステルの還元、アルコールのPCC酸化でアルデヒド (2-1) を得た。続いて、Wittig反応でスチレン体 (2-2) に変換し、アジドの亜鉛還元と生成したアミノ基をp -ノシルクロリドと反応させて (3-1) に導いた。 (1-1) を前述したルートでオキシム (2-2) に変換し、1,3-双極子付加環化反応に付したところ、望む8員環化合物は全く得られず、9員環生成物のジアステレオマー混合物が得られてしまった。前述のモデル化合物との違いはオルト位のMeO基による立体障害および電子供与が考えられる。何れにしてもこの問題を解決しなければ先に進めなくなった。 クマリン誘導体 (1-1) を用いればregiochemistryをコントロールできると考えたが、分子が剛直すぎて軌道の重なりが困難であったのか全く所望の付加体 (1-2) は得られなかった。 そこで、最後の手段として桂皮酸誘導体 (1-1) を用いて1,3-双極子付加環化反応を行うことにした。従来のルートで (1-1) からオキシム (2-1) を合成した。 出発物 (1-1) のオキシムからニトリルオキシド (1-2) を生成したところ単一の生成物 (2-2) が得られた。構造決定のためノシル基をチオフェノールで外してアミン (2-1) に変換し、得られた結晶をX線解析したところ図のような構造を有することが判明した。 エチルエステル (1-1) の還元はNaBH4を用いた。通常エステルの還元にははLiBH4/THF、LiEt3BH、もちろんLAHなどを使うが、α位に酸素などの電子吸引基が存在する場合はNaBH4を使っても還元できる。生成物をTFAA-Et3Nという条件でトリフロロアセチル化するとアルコールもエステル化されてしまうので、重曹水で加水分解することでトリフロロアセトアミド (1-2) を得た。次にホウ酸存在下でRaneyニッケル還元を行うとN-O結合が開裂し、イミンも加水分解されたケトンジオール (2-2) が得られた。ここでケトン (2-2) をNaHB(OAc)3で還元し、トリフロロアミドを加水分解すると単一の生成物 (2-1) が生成したが立体化学は決定していない。 vic-ジオール (1-1) を過ヨウ素酸ソーダで開裂し、生成したアルデヒドをNaBH4で還元して (1-2) を得た。次に、一級アルコールを選択的にTBS基で保護し、得られた (2-2) のアミンをMCPBAでヒドロキシルアミンに酸化した。それからヒドロキシルアミンを選択的にアセチル化してDess-Martin酸化に付するとケトン (2-1) が得られた。 (1-1) のアセチル基をヒドラジンで外すと渡環した単一の生成物 (1-2) が得られた。TBS基を除去した後に強酸性のイオン交換樹脂 (Amberlyst 15E) をメタノール中で作用させてアセトナイド除去した。酸触媒にイオン交換樹脂を使う事は普段はしないのだが、生成物がテトラオールで分液操作によるロスが心配だったので、樹脂を濾過して溶媒を留去するだけで生成物が得られる方法を用いた。(2-2) を穏和なアセトナイド生成条件に付すと、選択的に (2-1) が得られた。trans -ジオールのアセトナイド形成はcis -ジオールよりも遅いことは糖化学ではよく知られている。 FR-900482のヒドロキシメチル基とアジリジンの相対的立体化学を制御するために、まどろっこしいが必要な操作を行った。まず (1-1) の立体的に空いている水酸基をTES化し、混んだ水酸基をメシル化して (1-2) を得た。次に、TES基をTBAFで外してからNaHで処理するとエポキサイド (2-2) が生成した。エポキサイド (2-2) の開裂はLiN3で行い、生じた水酸基をメシル化して (2-1) が得られた。ジオールの保護をアセトナイドにしているのは環状炭酸エステルがエポキサイド開裂の条件に耐えられないからである。 (1-1) のアセトナイドをTFAで加水分解し、得られたジオールをトリホスゲンで環状炭酸エステル (1-2) に変換した。続くStaudinger反応でアジドを還元すると同時にアジリジンが生成し、更にアンモニア処理で環状炭酸エステルを開裂することによりFR-900482類縁体 (2-2) が得られた。 この研究をメインに行った陰性の神戸美香の修士論文からFR-900482類縁体のヒト白血病細胞への細胞毒性試験の結果を引用する。ご覧のようにアジリジンの絶対配置がFR-900482と反対にも関わらずほぼ同じ活性を示したのは注目に値する。以前、マイトマイシンCの鏡像異性体をニューヨーク市大のMaria Tomaszに送ったがMMCの半分くらいの活性があるとの報告があった事を思い出す。
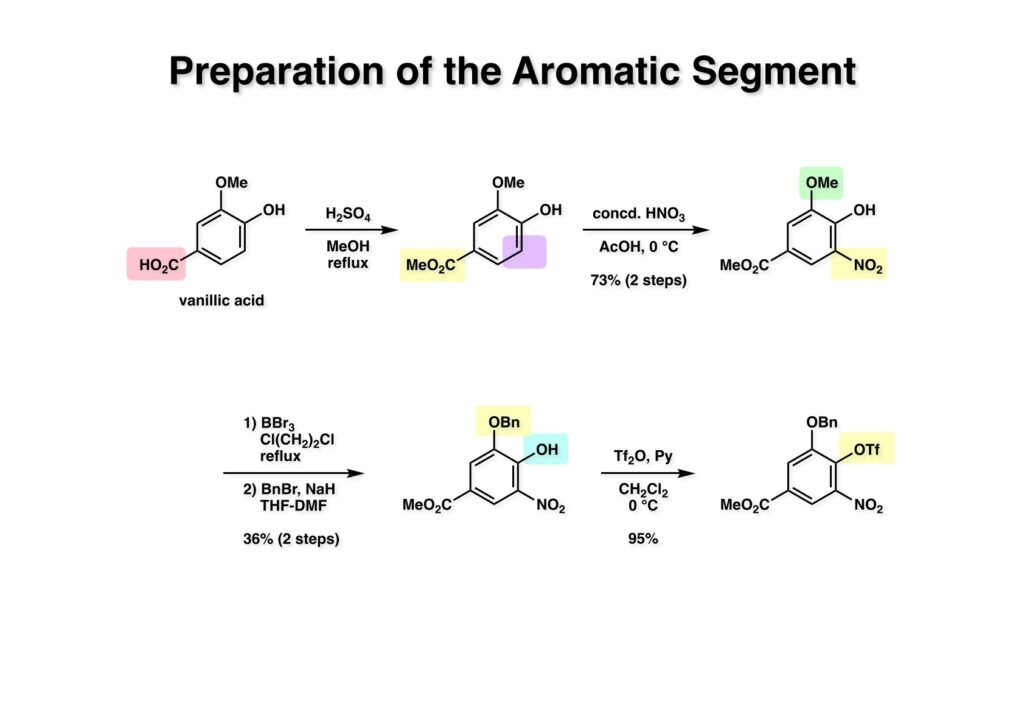
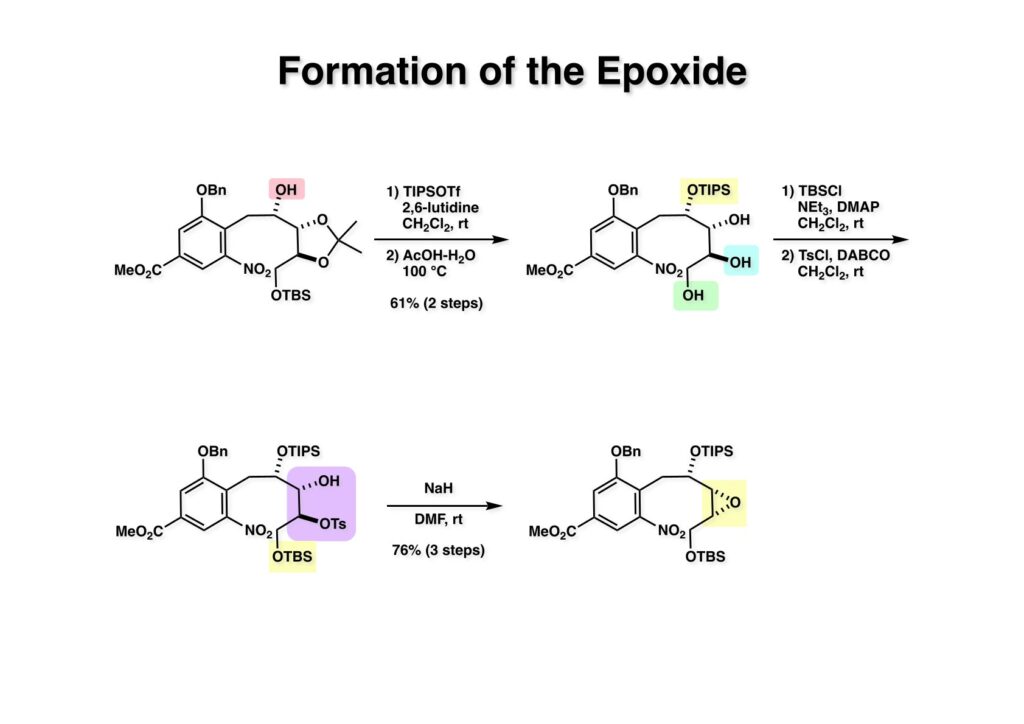
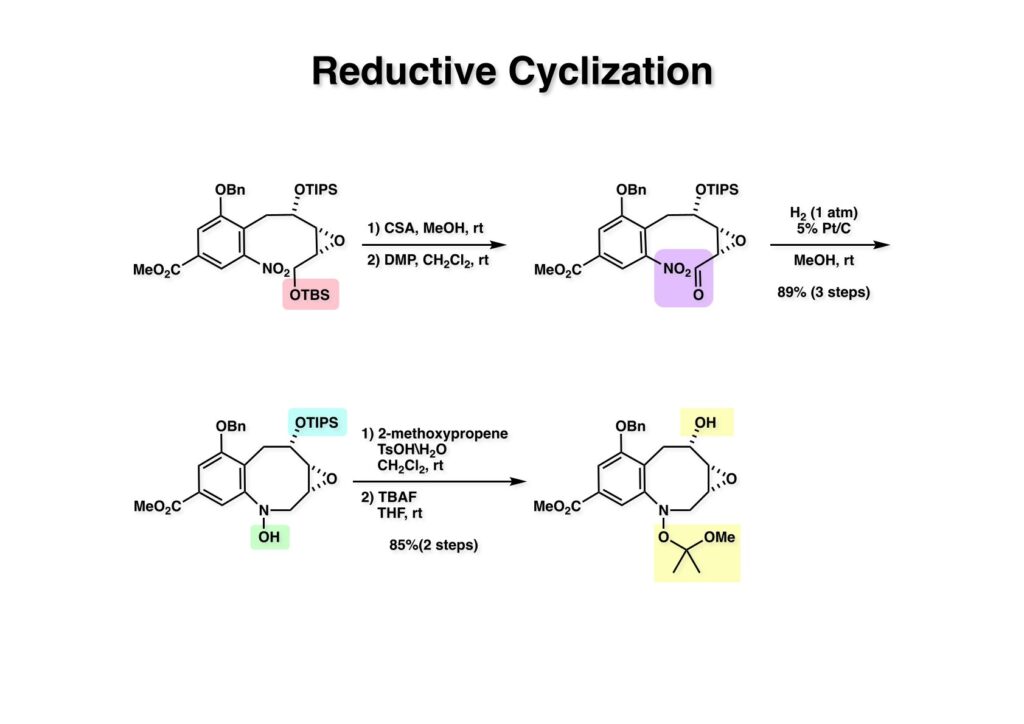
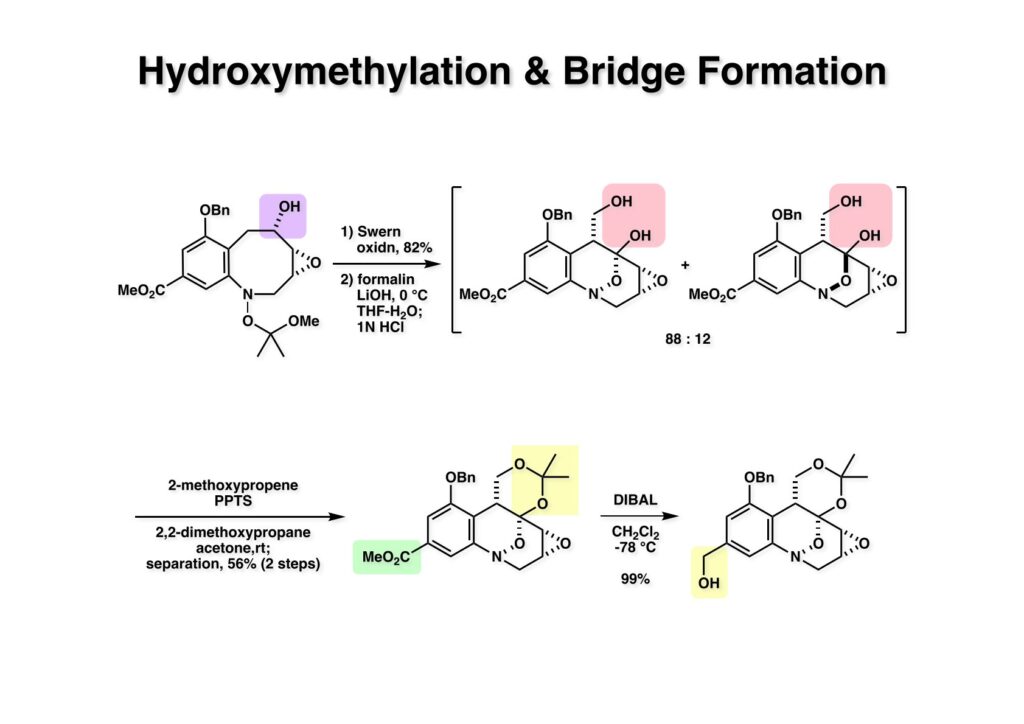
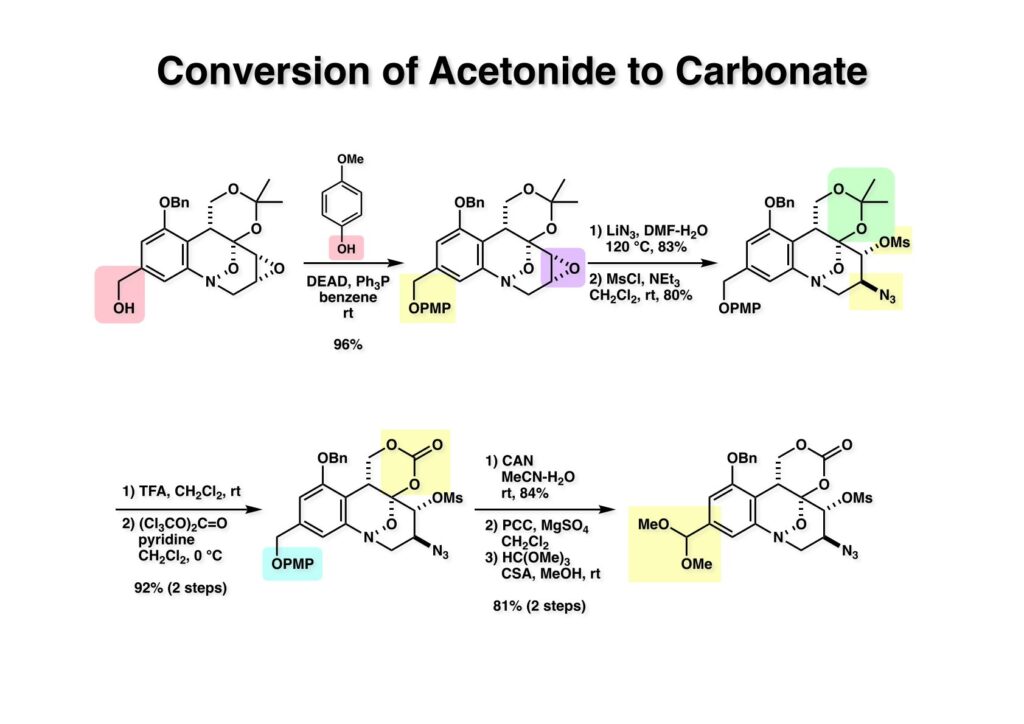
酒石酸を原料に使えば光学活性な FR-900482 の全合成が可能になることは、前回の類縁体合成で明らかになった。より短工程な光学活性FR-900482の全合成を目指す中でニトロベンゼンのオルト位にアセチレンを配置して2級アミンを共役付加させると2-置換のインドール合成法になることが分かった。これを元に次ページの逆合成解析を行った。 ここでのポイントは (2-3) のケトンをヒドロキシメチル化して (1-3) に変換することと、最大の山場はニトロ基の還元による (2-2) から (2-3) への環化反応で8員環 (2-3) 構築である。実はアミンをノシル化して光延反応で8員環を形成することには成功していたが、合成ルートが長くなることで途中で諦めた経緯がある。ケトン (2-1) は (3-1) へのアミンの共役付加とそれに続くエナミンの加水分解で得られるとし、(3-1) は薗頭カップリングで構築するとすれば (3-2) と (3-3) を合成の出発点とすることができる。 芳香環部分の合成は見たとおりで、市販のバニリン酸をエステル化し、ニトロ化すると (1-3) が得られる。OH基のオルト、パラ配向性とCO2Me基のメタ配向性を合わせるとニトロ化の位置は自ずと決まる。次の脱メチル化はBCl3では役不足で、特にオルト位にOH基があると無理なので、より強力なBBr3を使わなければならない。続くベンジル化は酸性度から言えばNO2のオルト位のフェノールの方がアニオンになりやすいので、NaHで強制的にジアニオンにし、立体的に空いていて反応性の高いアニオンの方をベンジル化して (2-1) を得た。残るフェノールは常法によりトリフレート (2-2) にした。 実は (2-4) のアセチレン-エポキサイドを合成して薗頭カップリングを試みたのだが、パラジウム触媒によって分解してしまったので、より安定な (2-3) を合成することにした。L-酒石酸エステル (1-1) をアセトナイドに変換した後にLAH還元してジオール体 (1-2) を得た、次にジオールの片方だけをTBS化し、得られた (1-3) をSwern酸化してアルデヒド (2-1) に変換した。アルデヒドにOhira-Bestmann試薬 (2-2) を作用させると望むアセチレン (2-3) が高収率で得られた。 (1-1) と (1-2) の薗頭カップリングは順調に進行し (1-3) を与えた。次にアセチレンに対してピロリジンを室温で付加させ、得られた付加体 (2-1) を単離することなく酢酸-水で加水分解すると望むケトン体 (2-2) が得られた。このケトンをZnBH4で還元するとZnイオンのキレート効果により9:1の比でアルコール (3-1) と (3-2) が得られた。 (1-1) の二級アルコールは酸性条件でかなり安定なTIPS基で保護し、次いでTBS基とアセトナイドを酢酸ー水で加熱加水分解して (1-2) を得た。得られたトリオール (1-2) の一級アルコールをTBS基で保護し、次に空いている二級水酸基をトシル化して (2-1) に変換した。TsClはMsClに比べて反応速度が遅いので反応が制御しやすいという特徴がある。(2-1) をNaHで処理すると容易にエポキサイド (2-2) を与えた。 (1-1) のTBS基を選択的に外すため酸性条件を用いた、生じた一級アルコールをDess -Martin酸化するとアルデヒド (1-2) が得られた。次のニトロ基の還元条件は触媒や溶媒の組み合わせを変えて検討したが、メタノール中でPt/C触媒を使うのが最適であると判明した。芳香族ニトロ化合物はPd触媒を使うとアミンにまで還元されてしますが、Rh触媒を使うとヒドロキシルアミンでうまく止まるという報告もある。何れにしても、確立された還元条件に付したところヒドロキシルアミン (2-1) が高収率で得られた。この水酸基の保護は混合アセトナイドを用いることにし、TIPS基をTBAFで外すことにより (2-2) を得た。(注)ヒドロキシルアミンの水酸基をアセテートなどのエステルで保護すると、後段階のヒドロキシメチル化において脱離が起きてしまうことが判明したため脱離能の低いエーテルとした経緯がある。 (1-1) の二級水酸基をSwern酸化し、過剰のホルマリン中0度でLiOHと反応させ、更に希塩酸を加えて混合アセトナイドを加水分解したところ88:12の比で渡環生成物 (1-2) と (1-3) が得られた。分離生成することなくアセトナイドに変換後に精製して (2-1) を得た。ここでメチルエステルをDIBAL還元してアルコール (2-2) が得られた。 (1-1) の水酸基をp -methoxypheny etherに変換し、エポキサイドをLiN3で開環後にメシル化することによって (1-3) を得た。前述のようにアセトナイド (1-3) を環状炭酸エステル (2-1) し、PMP基のCAN酸化による脱保護、PCC酸化によるアルデヒドへの変換、更にアセタール化して (2-2) が得られた。 Staudinger反応によるアジド (1-1) の還元で得られたアジリジン (1-2) のベンジル基を加水素分解し、注意深く酸性条件でアセタールを加水分解してアルデヒド (2-1) を得た。最後に (2-1) のTHF溶液にNH3ガスを通ずることでFR-900482 (2-2) が得られた。この天然物は小分子ながらも合成困難で忌々しい化合物だったと言える。