Tamiflu (Oseltamivir) がインフルエンザの症状を改善することが分かったが、当時は天然物のシキミ酸を原料としてHoffmann-La Rocheが製造していたので供給不足が懸念されていた。そこで、より簡単に入手可能な出発物から全合成でタミフルを供給しようとする機運が21世紀初頭に高まった。私はタミフルには興味が無く、構造式も知らなかったが東大薬学部の修士論文発表会で柴崎研の学生が発表するのを見て、ああ、あれがタミフルの構造かと知った次第である。簡単そうに見えるがちょっと面白い構造をしているので、その学生が発表している10分ちょっとの間に逆合成を考えて、ひょっとしたらこれで合成できるかもしれないと思った。発表会が終わってオフィスに帰りSciFinderでピリドンとアクリル酸エステルのDieols-Alder反応を検索したところ、比較的高温を要して、収率も高くなく、不斉合成も報告されていなかったので、なーんだ、ということでそのまましばらく机上に放置しておいた。後日、ジヒドロピリジンとアクロレインを使ってDave MacMillanの不斉Diels-Alder反応を使えば大丈夫ではないかと気が付き、学部生の佐藤信裕君に合成を開始してもらった。その後アステラス製薬のプロセス化学者である秋葉賢宏さんが助太刀してくれて合成が完成した。代表的な全合成の解説はWikipediaに簡単に説明されているのでそちらを参照されたい(https://en.wikipedia.org/wiki/Oseltamivir_total_synthesis)。
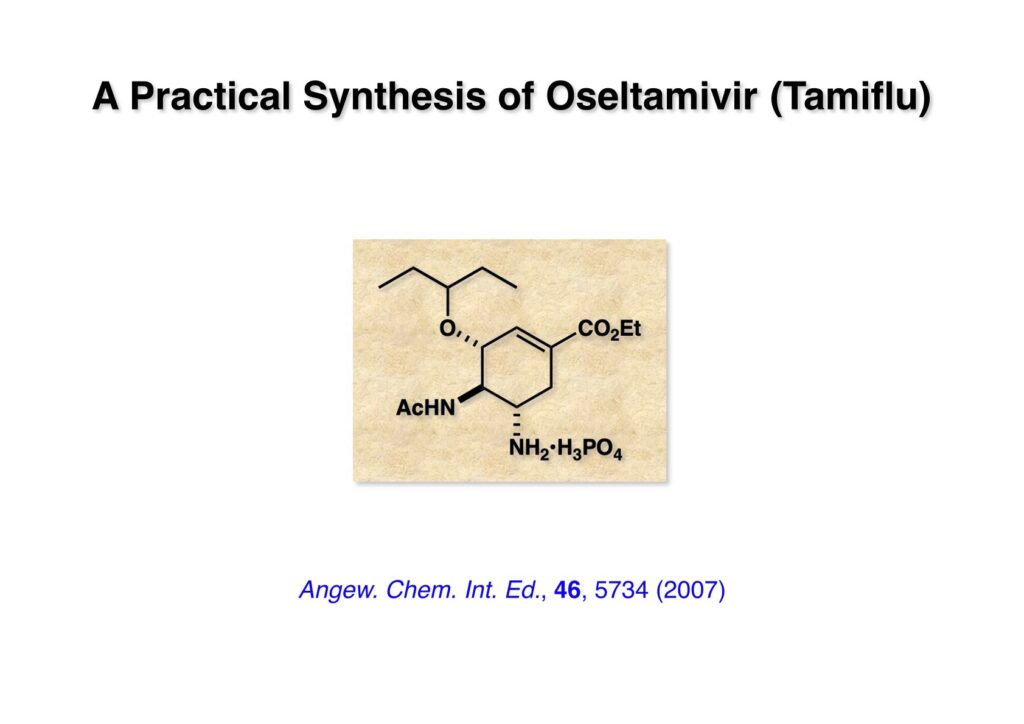
“A Practical Synthesis of (–)-Oseltamivir,” N. Satoh, T. Akiba, S. Yokoshima, and T. Fukuyama, Angew. Chem. Int. Ed., 46, 5734 (2007).
“A Practical Synthesis of (–)-Oseltamivir,” N. Satoh, T. Akiba, S. Yokoshima, and T. Fukuyama, Tetrahedron, 65, 3239-3245 (2009).
 2006年4月から6月の間にJACSにアクセスされた論文のランキングが発表されていて、1位と2位がタミフルの合成だった。因みに私たちのヤタケマイシン全合成の論文は6位となっていた。この全合成については後ほど解説する予定である。
2006年4月から6月の間にJACSにアクセスされた論文のランキングが発表されていて、1位と2位がタミフルの合成だった。因みに私たちのヤタケマイシン全合成の論文は6位となっていた。この全合成については後ほど解説する予定である。
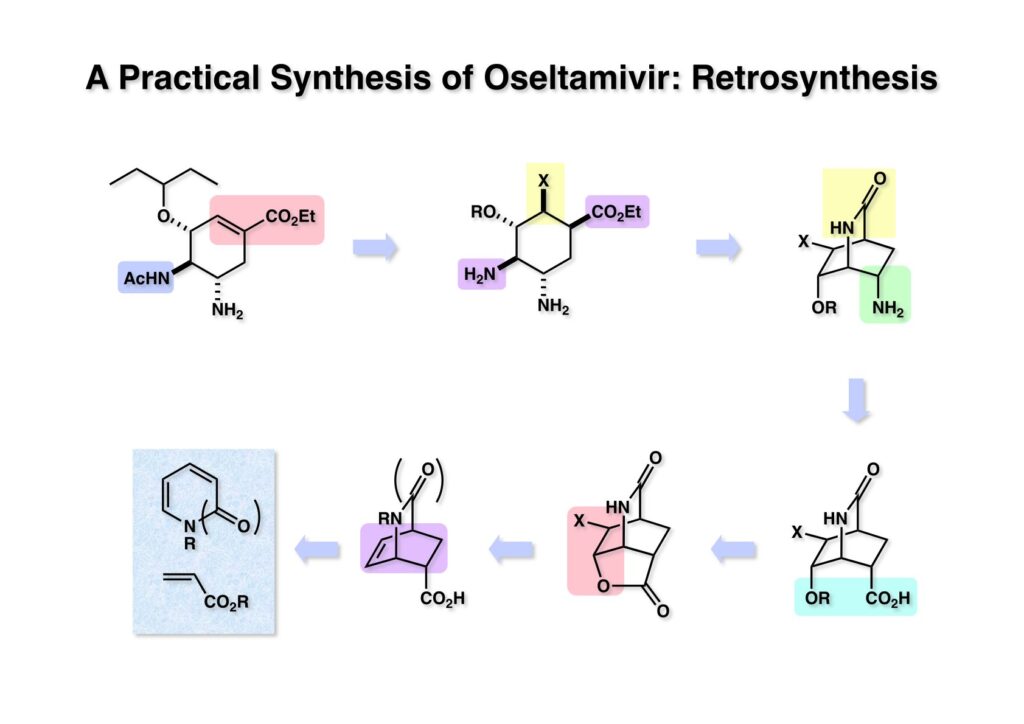 最初に考えた逆合成解析をここに示す。タミフル (1-2) のα,β-不飽和エステルに後で脱離基となるXを付加すると (1-2) となる。Corey先生の有機合成化学の講義では「functional group appendage」と名付けていた。こういう操作をすると逆合成に幅をもたせることができる。(1-2) にはアミンとエステルが1,4位にあるのでこれを結ぶとビシクロ[2.2.2]系のラクタム (1-3) となる。ここでアミンとカルボン酸は (Curtius転位やHofmann転位を介して) 等価であると考えれば (2-4) が等価体となる。(2-4) を見ればすぐに思い浮かぶのはラクトン体 (2-3) であり、またこれを見ればすぐに思い浮かぶのが (2-2) をハロラクトン化すれば (2-3) になるということである。(2-2) はピリドン (2-1) とアクリル酸エステル (3-1) とのDiels-Alder反応で構築できる、というのが修論発表会の場で考えた逆合成解析だった。残念ながらSciFinderによると、このDiels-Alder反応は収率も高くなく、不斉合成には不向きであることが分かった。その後しばらくしてMacMillanが鎖状のジエナミド(実際はウレタン)とアクロレインの間で不斉Diels-Alder反応が起きると報告していることが判明し、それでは (2-1) でカルボニル基のないジヒドロピリジンを使うことにした。
最初に考えた逆合成解析をここに示す。タミフル (1-2) のα,β-不飽和エステルに後で脱離基となるXを付加すると (1-2) となる。Corey先生の有機合成化学の講義では「functional group appendage」と名付けていた。こういう操作をすると逆合成に幅をもたせることができる。(1-2) にはアミンとエステルが1,4位にあるのでこれを結ぶとビシクロ[2.2.2]系のラクタム (1-3) となる。ここでアミンとカルボン酸は (Curtius転位やHofmann転位を介して) 等価であると考えれば (2-4) が等価体となる。(2-4) を見ればすぐに思い浮かぶのはラクトン体 (2-3) であり、またこれを見ればすぐに思い浮かぶのが (2-2) をハロラクトン化すれば (2-3) になるということである。(2-2) はピリドン (2-1) とアクリル酸エステル (3-1) とのDiels-Alder反応で構築できる、というのが修論発表会の場で考えた逆合成解析だった。残念ながらSciFinderによると、このDiels-Alder反応は収率も高くなく、不斉合成には不向きであることが分かった。その後しばらくしてMacMillanが鎖状のジエナミド(実際はウレタン)とアクロレインの間で不斉Diels-Alder反応が起きると報告していることが判明し、それでは (2-1) でカルボニル基のないジヒドロピリジンを使うことにした。
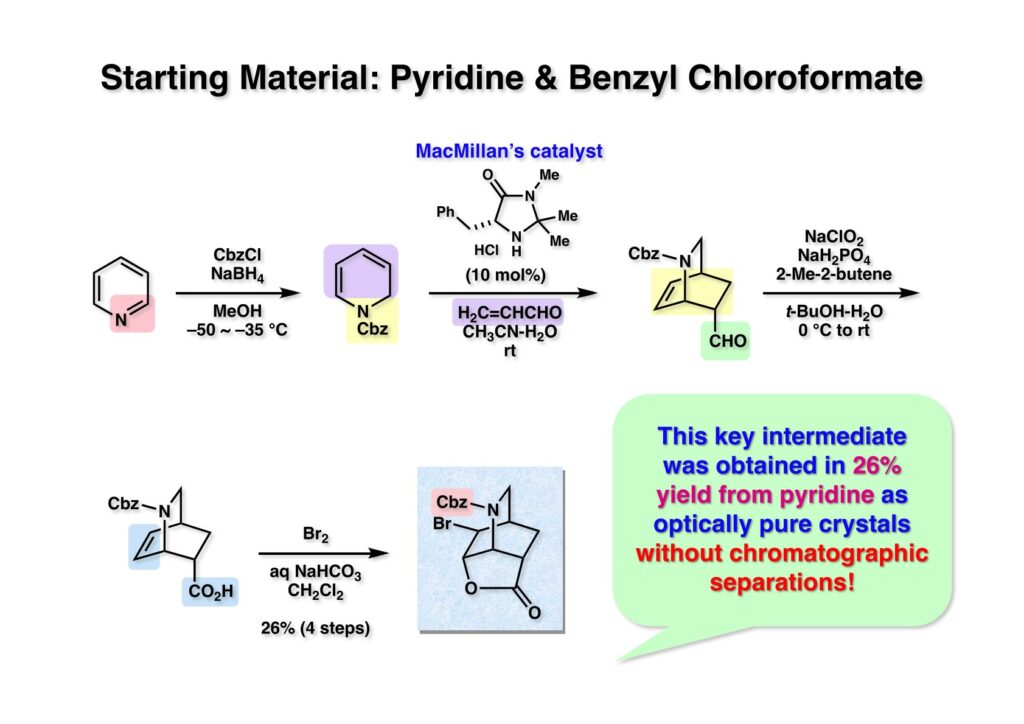 ピリジン (1-1) と1.1当量のNaBH4のメタノール溶液を-40 °Cに冷却し、温度をその近辺に保つような速度でCbzClを滴下し、20分その温度に保った後0 °Cまで昇温してから後処理するとほぼ定量的にジヒドロピリジン (1-2) が得られる。これを精製することなく0.1当量のMacMillan触媒 (1-3) と3当量のアクロレインの含水アセトニトリル溶液を室温で14時間放置してから後処理した。ここでも精製することなくKraus酸化の条件を使ってアルデヒド (1-4) をカルボン酸 (2-1) に酸化した。反応終了後に酢酸エチルと希塩酸の間で分液操作をして塩基性の不純物を除去し、さらに酢酸エチル層を重曹水で抽出することでカルボン酸を水層に移した。そこにCH2Cl2を加えて勢いよく撹拌しながら赤い色が消えなくなるまで臭素を加えていった。もし仮にDiels-Alder反応でエピマーが副生していても、この過程でブロモラクトン化は起きないのでカルボキシレートとして水層に残っている。反応液を酢酸エチルで抽出して、乾燥、留去後にメタノール中から結晶化することで光学的に純粋なブロモラクトン (2-2) がピリジンから通算収率26%で得られた。この間、クロマトによる分離操作は一切必要なく、収率こそ自慢できるほどではないが、簡単に重要中間体を合成することができた。この不斉Diels-Alder反応は、その後室蘭工科大学の中野博人教授によって開発された触媒を用いると飛躍的に収率が向上した。特にCbz基でなくPhOCO基が付いたジヒドロピリジンの場合endo-付加体が98% (96% ee) で得られている。中野先生の総合論文が有機合成化学協会誌, vol. 74, 720 (2016)に掲載されているので参照されたい。
ピリジン (1-1) と1.1当量のNaBH4のメタノール溶液を-40 °Cに冷却し、温度をその近辺に保つような速度でCbzClを滴下し、20分その温度に保った後0 °Cまで昇温してから後処理するとほぼ定量的にジヒドロピリジン (1-2) が得られる。これを精製することなく0.1当量のMacMillan触媒 (1-3) と3当量のアクロレインの含水アセトニトリル溶液を室温で14時間放置してから後処理した。ここでも精製することなくKraus酸化の条件を使ってアルデヒド (1-4) をカルボン酸 (2-1) に酸化した。反応終了後に酢酸エチルと希塩酸の間で分液操作をして塩基性の不純物を除去し、さらに酢酸エチル層を重曹水で抽出することでカルボン酸を水層に移した。そこにCH2Cl2を加えて勢いよく撹拌しながら赤い色が消えなくなるまで臭素を加えていった。もし仮にDiels-Alder反応でエピマーが副生していても、この過程でブロモラクトン化は起きないのでカルボキシレートとして水層に残っている。反応液を酢酸エチルで抽出して、乾燥、留去後にメタノール中から結晶化することで光学的に純粋なブロモラクトン (2-2) がピリジンから通算収率26%で得られた。この間、クロマトによる分離操作は一切必要なく、収率こそ自慢できるほどではないが、簡単に重要中間体を合成することができた。この不斉Diels-Alder反応は、その後室蘭工科大学の中野博人教授によって開発された触媒を用いると飛躍的に収率が向上した。特にCbz基でなくPhOCO基が付いたジヒドロピリジンの場合endo-付加体が98% (96% ee) で得られている。中野先生の総合論文が有機合成化学協会誌, vol. 74, 720 (2016)に掲載されているので参照されたい。
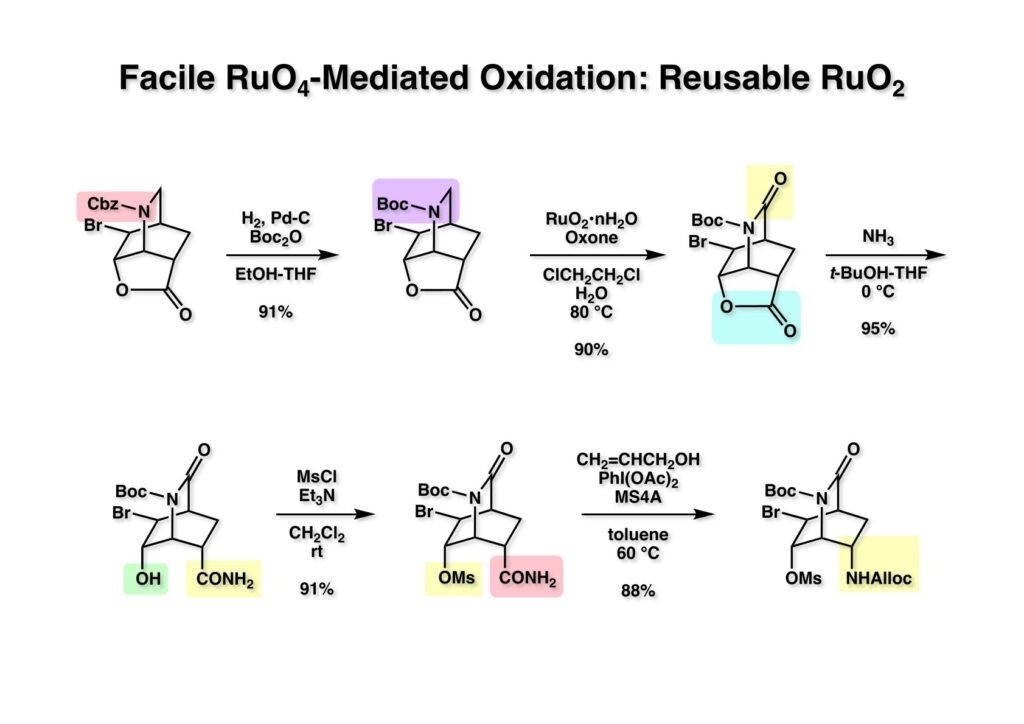 ここで (1-1) のウレタンの横のメチレン基をカルボニル基に酸化しなければならないので、Boc2O存在下でCbz基を加水素分解してBoc体 (1-2) に変換した。ウレタンやアミドはRuO4で酸化されてイミドに変換できることはよく知られている。私はRuO4は結構気に入っている酸化剤で、色々な場面で使える便利な試薬である。Chem-Stationに短い解説が載っているのでご覧下さい(https://www.chem-station.com/odos/2009/06/-oxidation-using-ruthenium-tet.html)。SharplessはRuCl3-NaIO4のコンビネーションがお気に入りだが、私は酢酸エチルを溶媒にしてRuO2-NaIO4を使う方が好きだ。ただし、RuO2·nH2Oを買うべきで、RuO2無水物を買うとお金をドブに捨てることになるので要注意(無水物は全然水に溶けず、NaIO4を加えても全く反応しない)。ここでは安価なOxoneを酸化剤として、ジクロロエタン-水を溶媒にして80 °Cに加熱した。反応が完結したらイソプロピルアルコールを加えてRuO4をRuO2に戻し、Buchner漏斗で濾過して高価なRuO2黒い粉末を回収した。回収したRuO2は次回に濾紙に付いたまま使用した。回収率は95%くらいだったかな、と淡い記憶が残っている。(1-3) の5員環ラクトンはかなり歪みがかかっていて0 °Cで加アンモニア分解されてアミド (2-1) が得られた。後にアジリジンを構築するために (2-1) の水酸基をメシル化して (2-2) を得た。次にアミドをアリルアルコール-トルエン中でDAIB [(diacetoxyiodo)benzene)] を使ってHofmann転位を行い、ウレタン (2-3) を高収率で得た。DAIBはMerckのプロセスでトン単位で使ったというから安全な酸化剤と言える。
ここで (1-1) のウレタンの横のメチレン基をカルボニル基に酸化しなければならないので、Boc2O存在下でCbz基を加水素分解してBoc体 (1-2) に変換した。ウレタンやアミドはRuO4で酸化されてイミドに変換できることはよく知られている。私はRuO4は結構気に入っている酸化剤で、色々な場面で使える便利な試薬である。Chem-Stationに短い解説が載っているのでご覧下さい(https://www.chem-station.com/odos/2009/06/-oxidation-using-ruthenium-tet.html)。SharplessはRuCl3-NaIO4のコンビネーションがお気に入りだが、私は酢酸エチルを溶媒にしてRuO2-NaIO4を使う方が好きだ。ただし、RuO2·nH2Oを買うべきで、RuO2無水物を買うとお金をドブに捨てることになるので要注意(無水物は全然水に溶けず、NaIO4を加えても全く反応しない)。ここでは安価なOxoneを酸化剤として、ジクロロエタン-水を溶媒にして80 °Cに加熱した。反応が完結したらイソプロピルアルコールを加えてRuO4をRuO2に戻し、Buchner漏斗で濾過して高価なRuO2黒い粉末を回収した。回収したRuO2は次回に濾紙に付いたまま使用した。回収率は95%くらいだったかな、と淡い記憶が残っている。(1-3) の5員環ラクトンはかなり歪みがかかっていて0 °Cで加アンモニア分解されてアミド (2-1) が得られた。後にアジリジンを構築するために (2-1) の水酸基をメシル化して (2-2) を得た。次にアミドをアリルアルコール-トルエン中でDAIB [(diacetoxyiodo)benzene)] を使ってHofmann転位を行い、ウレタン (2-3) を高収率で得た。DAIBはMerckのプロセスでトン単位で使ったというから安全な酸化剤と言える。
 このページのタイトルは「一石三鳥」で、逆合成解析のページには書いてないが、合成を始める前からこのイメージは持っていた。
このページのタイトルは「一石三鳥」で、逆合成解析のページには書いてないが、合成を始める前からこのイメージは持っていた。
(1-1) をエタノール中で2.02当量のNaOEtで処理すると、まずN-Bocラクタムが攻撃されてエチルエステル-カーバメート (1-2) になる。次にエステルのα位が脱プロトン化されてBr-が脱離してα,β-不飽和エステル (2-2) に変換され、さらにNHが脱プロトン化されてN-Bocアジリジン (2-1) が高収率で得られた。
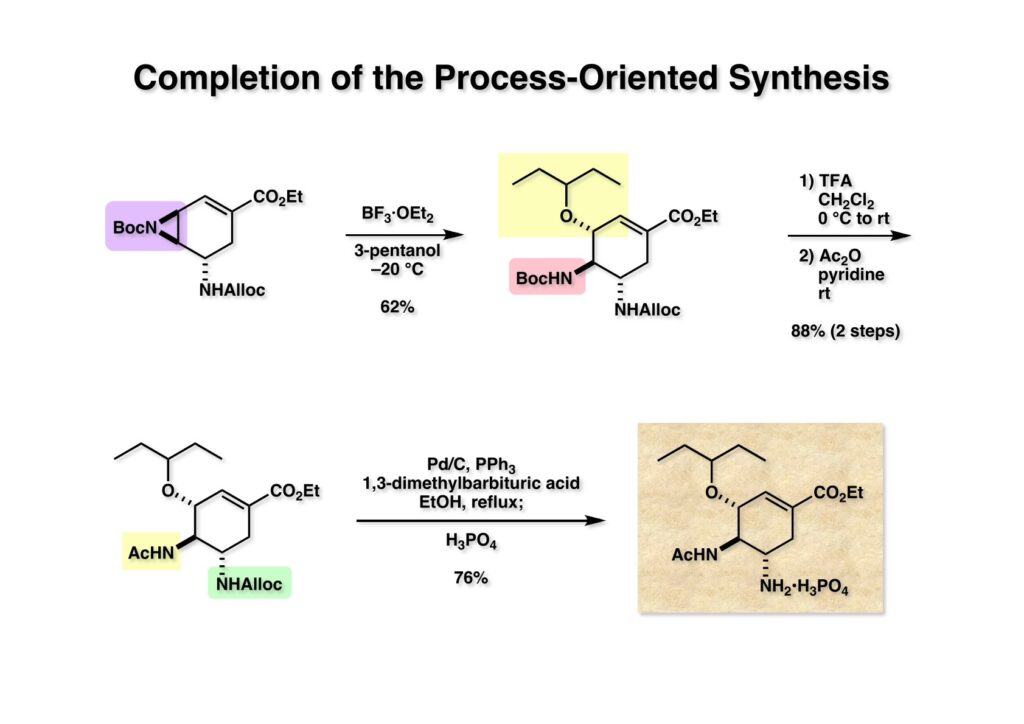 アジリジン (1-1) の2-pentanolによる開環反応はもっと収率を改善したかったが、再現性よく62%くらいで (1-2) が得られるようになったのでそこで諦めた。(1-2) のBoc基をTFAで除去し、無水酢酸-ピリジンでアセチル化して (2-1) に導いた。最終段階ではパラジウムをタミフルに混在させないようにPd/CとPPh3を触媒とし、1,3-dimethybarbituric acidでアリル基をトラップした。反応終了後に触媒を濾過し、エタノールをある程度濃縮してから1当量のリン酸を加え、さらにタミフルの種を入れて結晶化して76%の収率で白色のタミフルの結晶を得た。インフルエンザの特効薬というほどのものでもないけど、まあ、こんな作り方もありますよ、ということで。
アジリジン (1-1) の2-pentanolによる開環反応はもっと収率を改善したかったが、再現性よく62%くらいで (1-2) が得られるようになったのでそこで諦めた。(1-2) のBoc基をTFAで除去し、無水酢酸-ピリジンでアセチル化して (2-1) に導いた。最終段階ではパラジウムをタミフルに混在させないようにPd/CとPPh3を触媒とし、1,3-dimethybarbituric acidでアリル基をトラップした。反応終了後に触媒を濾過し、エタノールをある程度濃縮してから1当量のリン酸を加え、さらにタミフルの種を入れて結晶化して76%の収率で白色のタミフルの結晶を得た。インフルエンザの特効薬というほどのものでもないけど、まあ、こんな作り方もありますよ、ということで。







